
【题目】第VA族元素的原子R与A原子结合形成RA3气态分子,其立体结构呈三角锥形。RCl5在气态和液态时,分子结构如下图所示,下列关于RCl5分子的说法中正确的是

A.每个原子都达到8电子稳定结构
B.分子中5个R-Cl键键能相同
C.键角(Cl-R-Cl)有90°、120°、180°几种
D.RCl5受热后会分解生成分子RCl3,RCl5和RCl3都是极性分子
【答案】C
【解析】
A.R是第VA族元素的原子,R原子最外层有5个电子,RCl5形成5个共用电子对,所以R不属于8电子稳定结构,故A错误;
B.键长越短,键能越大,键长不同,所以键能不同,故B错误;
C.上下两个顶点与中心R原子形成的键角为180°,中间为平面三角形,构成三角形的键角为120°,顶点与平面形成的键角为90°,所以键角(Cl-R-Cl))有90°、120°、180°几种,故C正确;
D.R是第VA族元素的原子,RCl5中心原子R最外层有5个电子,最外层电子完全和Cl原子发生共用,所以RCl5为非极性分子;RCl3最外层电子数只有3个电子和Cl原子发生共用,所以RCl3是极性分子,故D 错误;
故答案为C。


科目:高中化学 来源: 题型:
【题目】纪录片《我在故宫修文物》展示了专家精湛的技艺和对传统文化的热爱与坚守,也让人体会到化学方法在文物保护中的巨大作用。
Ⅰ.某博物馆修复出土铁器的过程如下:
(1)检测锈蚀物的成分。
锈蚀物主要成分的化学式 | |||
Fe3O4 | Fe2O3·H2O | FeO(OH) | FeOCl |
FeOCl中铁元素的化合价为_______。
(2)化学修复方法:脱氯、还原,形成Fe3O4保护层。(已知:Cl-会加快铁的腐蚀)
修复过程:将铁器浸没在盛有0.5 mol·L-1 Na2SO3、0.5 mol·L-1 NaOH溶液的容器中,缓慢加热至60~90℃,一段时间后取出器物,用NaOH溶液洗涤至无Cl-。
①脱氯反应:FeOCl + OH- = FeO(OH) + Cl-。离子反应是向着离子浓度减小的方向进行的,则相同温度下,FeOCl与FeO(OH)的溶解度:s(FeOCl)______s[FeO(OH)](填>、<或=)。
②还原反应:Na2SO3还原FeO(OH)形成Fe3O4。配平化学方程式:
___Na2SO3 + ___FeO(OH) = ___Na2SO4 + ___Fe3O4 + ___H2O
③检验Cl-是否洗涤干净的方法是_______________。
Ⅱ.若要配制500mL 0.5mol·L-1的NaOH溶液用于洗涤器物,回答下列问题:
(3)配制时,应用天平称取NaOH的质量为___________(精确到小数点后两位)。
(4)某操作步骤如图所示:
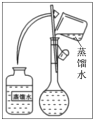
该操作应放在如图所示的____________(填序号)操作之间。
①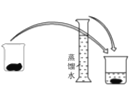 ②
②![]() ③
③![]() ④
④![]() ⑤
⑤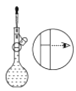 ⑥
⑥![]()
(5)下列说法错误的是_____________(填标号)。
A.称量NaOH固体的时间不宜过长
B.待烧杯中溶液冷却至室温才进行转移
C.定容时,仰视容量瓶刻度线会使配制的NaOH溶液浓度偏高
D.容量瓶可存放配好的NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼元素为人体及动植物必须的微量元素,也在钢铁工业中的有着重要的作用,钼作为钢的合金化元素,可以提高钢的强度,特别是高温强度和韧性。我国钼元素的储量丰富,在世界上占第二位。如图所示是钼元素的相关信息,下列有关钼的说法错误的是

A.95Mo18O42-(钼酸根离子)中共计有 76 个电子
B.95Mo 的相对原子质量是 95.96
C.92Mo、95Mo、98Mo 互为同位素,化学性质几乎相同
D.98Mo 的原子核内有 56 个中子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为3L的密闭容器中化学反应CO(g)+2H2(g)![]() CH3OH(g)达到平衡状态。
CH3OH(g)达到平衡状态。
(1)该反应的平衡常数表达式K=__;根据图,升高温度,K值将__(填“增大”、“减小”或“不变”)。

(2)500℃时,从反应开始到化学平衡状态,以H2的浓度变化表示的化学反应速率是__(用nB、tB表示)。
(3)判断该可逆反应达到化学平衡状态的标志是__(填字母,下同)。
a.υ生成(CH3OH)=υ消耗(CO) b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变 d.CO、H2、CH3OH的浓度均不再变化
(4)300℃时,将容器的容积压缩到原来的![]() ,在其他条件不变的情况下,对平衡体系产生的影响是____。
,在其他条件不变的情况下,对平衡体系产生的影响是____。
a.c(H2)减小 b.正反应速率加快,逆反应速率减慢
c.CH3OH的物质的量增加 d.重新平衡时![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用浓度为0.1000mol/L的盐酸分别逐滴加入到20.00mL0.1000mol/L的两种一元碱MOH、ROH溶液中,pH随盐酸溶液体积的变化如图所示。下列说法正确的是( )

A.pH=10时,c(M+)>c(MOH)>c(Cl-)>c(OH-)>c(H+)
B.将上述MOH、ROH溶液等体积混合后,用盐酸滴定至MOH恰好反应时:c(R+)>c(M+)>c(H+)>c(OH-)
C.10mL<V(HCl)<20mL时,c(M+)+c(MOH)<c(Cl-)
D.V(HCl)>20mL时,不可能存在:c(Cl-)>c(M+)=c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g),反应过程中的能量变化情况如图所示。
CH3OH(g),反应过程中的能量变化情况如图所示。
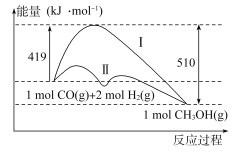
(1)曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。该反应是________(填“吸热”或“放热”)反应。计算当反应生成1.5 mol CH3OH(g)时,能量变化是________kJ。
(2)选择适宜的催化剂________(填“能”或“不能”)改变该反应的反应热。
(3)推测反应CH3OH(g)![]() CO(g)+2H2(g)是________(填“吸热”或“放热”)反应。
CO(g)+2H2(g)是________(填“吸热”或“放热”)反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20ml0.1mol/L氨水溶液中滴加盐酸,溶液中水电离的氢离子浓度随加入盐酸体积变化如图所示。则下列说法正确的是( )
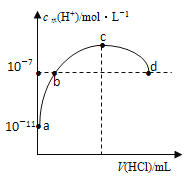
A.b、d两点为恰好完全反应点
B.c点溶液中c(NH4+)=c(Cl-)
C.a、b之间的任意一点:c(Cl-)>c(NH4+),c(H+)>c(OH-)
D.常温下,0.1mol/L氨水的电离常数K约为1×10-5mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于各图的叙述正确的是( )



A.甲表示![]() 与
与![]() 发生反应过程中的能量变化,则
发生反应过程中的能量变化,则![]() 的燃烧热为
的燃烧热为![]()
B.乙表示A、B两物质的溶解度随温度变化情况,将![]() 时A、B的饱和溶液分别升温至
时A、B的饱和溶液分别升温至![]() 时,溶质的质量分数
时,溶质的质量分数![]()
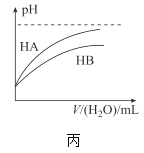
C.丙表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则相同浓度的NaA溶液的pH小于同浓度NaB溶液的pH
D.丁表示![]() 溶液滴定
溶液滴定![]() 醋酸溶液得到的滴定曲线
醋酸溶液得到的滴定曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将![]() 缓慢通入水中至饱和,然后向其中滴加
缓慢通入水中至饱和,然后向其中滴加![]() 溶液。整个实验过程中溶液的pH变化曲线如图所示,不考虑次氯酸分解,下列叙述正确的是
溶液。整个实验过程中溶液的pH变化曲线如图所示,不考虑次氯酸分解,下列叙述正确的是![]()
![]()
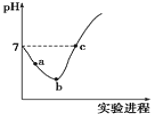
A.![]() 段,溶液中
段,溶液中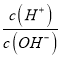 减小
减小
B.c点对应溶液中:![]()
C.b点对应溶液中:![]()
D.实验过程中用pH试纸测定溶液的pH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com