
【题目】钼元素为人体及动植物必须的微量元素,也在钢铁工业中的有着重要的作用,钼作为钢的合金化元素,可以提高钢的强度,特别是高温强度和韧性。我国钼元素的储量丰富,在世界上占第二位。如图所示是钼元素的相关信息,下列有关钼的说法错误的是

A.95Mo18O42-(钼酸根离子)中共计有 76 个电子
B.95Mo 的相对原子质量是 95.96
C.92Mo、95Mo、98Mo 互为同位素,化学性质几乎相同
D.98Mo 的原子核内有 56 个中子
科目:高中化学 来源: 题型:
【题目】取 1LFeCl3 溶液腐蚀铜板制作电路板,反应后在此残留液中慢慢加入铁粉,溶液中 Fe2+的浓度变化如图所示(加入固体引起的体积变化忽略不计),下列说法不正确的是

A. 当n(Fe)=0.5mol 时,发生的离子反应为 Fe+2Fe3+=3Fe2+
B. 当 n(Fe)=1.5mol 时,溶液中发生的总反应离子方程式为4Fe3++Cu2++3Fe=7Fe2++Cu
C. 当n(Fe)=1mol 时,溶液中 c(Fe2+)=5 mol·L-1
D. 腐蚀之前原溶液中 c(Fe3+)=4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】脂环烃分子中两个或两个以上碳环共有两个以上碳原子的烃称为桥环烃,二环[4.1.0]庚烷(![]() )是一种典型的桥环烃,下列关于二环[4.1.0]庚烷的说法错误的是( )
)是一种典型的桥环烃,下列关于二环[4.1.0]庚烷的说法错误的是( )
A. 与环庚烯互为同分异构体
B. 所有的碳原子均在同一平面上
C. 一氯代物有4种(不考虑立体异构)
D. 1mol二环[4.1.0]庚烷完全燃烧时消耗10molO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚砜(SOCl2)常用于医药、农药、染料工业,也可在有机合成工业中作氯化剂。已知:SOCl2的相关性质如下表所示:
颜色、状态 | 熔点 | 沸点 | 腐蚀性 | 水解 |
无色或微黄液体 | -105℃ | 78℃ | 强 | 极易水解 |
现利用如图装置制备SOCl2。

请回答下列问题:
Ⅰ.制备SO2和Cl2。
(1)本实验选用装置甲制备SO2和Cl2,装置甲中仪器x的名称为___;若以KMnO4和浓盐酸反应制备Cl2,反应的离子方程式为___。
Ⅱ.制备SOCl2。
以活性炭作为催化剂,SO2和C12可以和S粉在180~200℃时反应合成SOCl2,选用装置A、B、C、D进行制备(夹持、加热装置略去)。
(2)按气流从左到右的方向,装置A、B、C、D的连接顺序为___(填仪器接口的字母编号)。
(3)试剂y为___(填选项字母,下同);试剂z为___。
A.热水 B.乙醇 C.石蜡油 D.冰水
(4)装置A中U形管内发生反应的化学方程式为___。
(5)装置C的作用为___;若装置A处通入的SO2和Cl2的物质的量之比为1:3,则装置C中生成的盐为___(填化学式);请设计实验验证装置C中生成的盐中含有SO42-:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我们可以从海水中可制取许多化工原料。以下是某化工厂对海水加工的示意图:
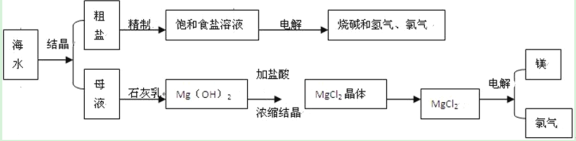
根据以上工艺流程回答下列问题:
(1)饱和食盐水被电解的化学方程式______。
(2)海水结晶过滤的母液中含有 K+ 、 Na+ 、 Mg2+等阳离子,从图中可看出对母液进行一系列的加工可制得金属镁。
①充分考虑当地海洋化学资源,从提高生产与经济效益的角度考虑,生产生石灰的主要原料是_______。
②熔融氯化镁电解制镁的化学方程式是______。
③生产过程所得的镁蒸气在特定的环境里冷却后可得固态的金属镁,下列物质中可以用作镁蒸气的冷却剂的是(填写代号)_______。
A.空气 B.Ar C.H2 D.CO2
(3)在该化工厂中,海水提取氯化钠后的母液经过提取氯化镁后又形成了新的母液,向新母液中加入氯气,又制取了重要的化工原料溴单质
①生成溴单质的化学反应的化学方程式是______,从溴苯混合物中分离出溴单质来应采用______(填实验方法)。
②获取生产单质溴的原料氯气,以下设想合理的是______(填写代号).
A 本厂生产镁单质处循环 B 从本厂生产烧碱处循环
C 在当地新建生产厂 D 从外地购买
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 ![]() 和
和![]() 是钍的两种同位素,
是钍的两种同位素,![]() 可以转化成
可以转化成![]() 。下列有关 Th 的说法正确的是( )
。下列有关 Th 的说法正确的是( )
①Th 元素的质量数是 232 ②![]() 和
和![]() 的化学性质相同 ③
的化学性质相同 ③![]() 转换成
转换成![]() 是化学变化 ④Th 元素的相对原子质量是 231 ⑤
是化学变化 ④Th 元素的相对原子质量是 231 ⑤![]() 和
和 ![]() 具有相同的最外层电子数
具有相同的最外层电子数
A.①②B.③④C.②⑤D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次氯酸锂稳定性远髙于次氯酸钠,也可用于杀菌消毒。制备次氯酸锂方法较多,常用的一种合成路线如图:
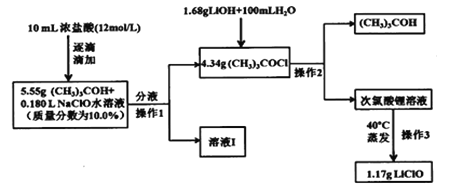
已知:1.次氯酸叔丁酯((CH3)3COCl),相对分子质量为108.5,是具有挥发性的黄色油状液体,密度为0.802g/mL,且有强烈刺激性臭味;
2.(CH3)3COCl+LiOH=LiClO+(CH3)3COH
请回答:
(1)实验第一步的反应装置如图所示(夹持装置省略),①B装置中支管的作用是________;②浓盐酸逐滴滴加而不是一次性加入的原因是__________。
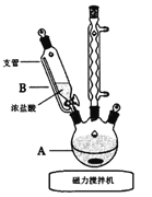
(2)请写出在装置A中发生反应的化学方程式______________。
(3)进行操作3时,并不是直接加热蒸发溶液,而是选择在40°C下缓慢蒸发溶液,试解释其原因___________。
(4)该实验中次氯酸锂的产率为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某l00mL溶液可能含有Na+、NH4+、Fe3+、CO32 -、SO42 -、Cl-中的若干种,取该溶液进行连续实验,实验过程如图:(所加试剂均过量,气体全部逸出)下列说法不正确的是( )

A. 原溶液一定存在CO32 -和SO42 -,一定不存在Fe3+
B. 是否存在Na+只有通过焰色反应才能确定
C. 原溶液一定存在Na+,可能存在Cl-
D. 若原溶液中不存在Cl-,则c (Na+) =0.1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的SO2(g)和O2(g)分别通入体积为2L的恒容密闭容器中,在不同温度下进行反应:2SO2(g)+ O2(g)![]() 2SO3 △H<0。得到如表中的两组数据,下列说法不正确的是
2SO3 △H<0。得到如表中的两组数据,下列说法不正确的是
实验编号 | 温度/℃ | 平衡常数/mol-1·L | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
SO2 | O2 | SO2 | O2 | ||||
1 | T1 | K1 | 4 | 2 | x | 0.8 | 6 |
2 | T2 | K2 | 4 | 2 | 0.4 | y | t |
A. T1、T2的关系:T1 > T2
B. x= 1.6,y=0.2 ,t<6
C. K1、K2的关系:K2>K1
D. 实验1在前6min的反应速率υ(SO2)=0.2 mol·L-1·min-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com