
【题目】次氯酸锂稳定性远髙于次氯酸钠,也可用于杀菌消毒。制备次氯酸锂方法较多,常用的一种合成路线如图:
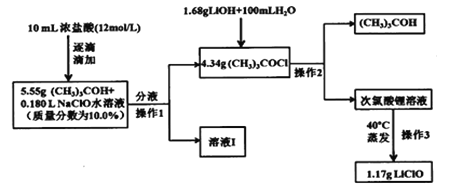
已知:1.次氯酸叔丁酯((CH3)3COCl),相对分子质量为108.5,是具有挥发性的黄色油状液体,密度为0.802g/mL,且有强烈刺激性臭味;
2.(CH3)3COCl+LiOH=LiClO+(CH3)3COH
请回答:
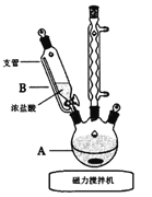
(1)实验第一步的反应装置如图所示(夹持装置省略),①B装置中支管的作用是________;②浓盐酸逐滴滴加而不是一次性加入的原因是__________。
(2)请写出在装置A中发生反应的化学方程式______________。
(3)进行操作3时,并不是直接加热蒸发溶液,而是选择在40°C下缓慢蒸发溶液,试解释其原因___________。
(4)该实验中次氯酸锂的产率为_________。
【答案】平衡气压,使浓盐酸顺利下滴 防止反应太剧烈而发生副反应,引起产率降低 (CH3)3COH+NaClO+HCl=(CH3)3COCl+NaCl+H2O 蒸发时,溶液温度太高,会引起次氯酸根的水解,且生成的次氯酸不稳定,导致产品产率和纯度降低 50.0%
【解析】
(1)B装置中支管使滴液漏斗中液面上方气压与三颈烧瓶中液面上方的气压相等;从反应速率和物质转化率方面分析;
(2)装置A中(CH3)3COH、NaClO、HCl反应有(CH3)3COCl生成,整个过程为NaClO与HCl反应生成NaCl与HClO,HClO与(CH3)3COH发生酯化反应生成(CH3)3COCl与H2O;
(3)从次氯酸盐的水解、HClO的分解分析判断;
(4)先4.34g(CH3)3COCl、1.68gLiOH的物质的量,结合二者按物质的量1:1反应,判断哪种物质过量,然后以不足量的物质为标准计算,(CH3)3COH的理论产量为0.04mol,再结合产率=![]() ×100%计算。
×100%计算。
(1)①B装置中支管使滴液漏斗中液面上方气压与三颈烧瓶中液面上方的气压相等,可以平衡气压,使浓盐酸顺利下滴;
②浓盐酸逐滴滴加而不是一次性加入,原因是防止反应太剧烈而发生副反应,引起产率降低;
(2)装置A中(CH3)3COH、NaClO、HCl反应有(CH3)3COCl生成,整个过程为NaClO与HCl反应生成NaCl与HClO,HClO与(CH3)3COH发生酯化反应生成(CH3)3COCl与H2O,反应方程式为:(CH3)3COH+NaClO+HCl=(CH3)3COCl+NaCl+H2O;
(3)进行操作3时,并不是直接加热蒸发溶液,而是选择在40°C下缓慢蒸发溶液,原因是蒸发时,若溶液温度太高,会引起次氯酸根的水解反应程度增大,且生成的次氯酸不稳定,导致产品产率和纯度降低,故选择在40°C下缓慢蒸发溶液;
(4)4.34g(CH3)3COCl的物质的量为4.34g÷108.5g/mol=0.04mol,1.68gLiOH的物质的量为1.68g÷24g/mol=0.07mol,二者按物质的量1:1反应,故(CH3)3COCl不足量,则(CH3)3COH的理论产量为0.04mol,产率=![]() ×100%=
×100%=![]() ×100%=50.0%。
×100%=50.0%。


科目:高中化学 来源: 题型:
【题目】某氯原子的质量是a g ,12C原子的质量是b g ,用NA表示阿佛加德罗常数,下列说法中正确的是( )
①氯元素的相对原子质量一定是![]() ② m g该氯原子的物质的量一定是
② m g该氯原子的物质的量一定是![]() mol③该氯原子的摩尔质量是aNA g/ mol④ a g该氯原子所含质子数是17NA
mol③该氯原子的摩尔质量是aNA g/ mol④ a g该氯原子所含质子数是17NA
A. ①③B. ①④C. ②③D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一刚性密闭容器内部有一不漏气且可滑动的活塞将容器分成左右两个室,左室内充入一定体积的CO和H2O气体,右室充入SO2和O2两种气体,且SO2和O2的物质的量之比为2:1,左右两室内各可发生如下反应:
左室 CO(气)+H2O(气) ![]() CO2(气)+H2(气)△H<0
CO2(气)+H2(气)△H<0
右室 2SO2(气)+O2(气) ![]() 2SO3(气) △H<0
2SO3(气) △H<0
反应开始时活塞停留在离左端点3/7处,反应在恒温下进行,当达平衡状态时,活塞处于容器中间。下列叙述正确的是
![]()
A. 右室气体反应前后的压强之比为4:3
B. 反应达平衡时气体SO2的转化率为75%
C. 平衡时再向左室中充入与原物质的量之比相同的CO和H2O气体,达平衡时,CO的物质的量分数不变 ,SO2的物质的量分数变大
D. 若原容器中左右两室起始时充入的各物质的量均为原来的两倍,达平衡时,活塞相对于中间位置将偏左
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼元素为人体及动植物必须的微量元素,也在钢铁工业中的有着重要的作用,钼作为钢的合金化元素,可以提高钢的强度,特别是高温强度和韧性。我国钼元素的储量丰富,在世界上占第二位。如图所示是钼元素的相关信息,下列有关钼的说法错误的是

A.95Mo18O42-(钼酸根离子)中共计有 76 个电子
B.95Mo 的相对原子质量是 95.96
C.92Mo、95Mo、98Mo 互为同位素,化学性质几乎相同
D.98Mo 的原子核内有 56 个中子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、W 为五种短周期元素,X、Y、Z 是原子序数依次递增的同周期元素,且最外层电子数之和为 15;X 与 Z 可形成 XZ2 分子;Y 与 M 形成的气态化合物在标准状态下的密度为 0.76 g·L-1;W 的质子数是 X、Y、Z、M 四种元素质子数之和的 1/2。下列说法正确的是( )
A.原子半径:W>X>Y>Z>M
B.XZ2、X2M2、W2Z2 均为直线形的共价化合物
C.CaM2 和 CaZ2 两种化合物中,阳离子与阴离子个数比均为 1∶2
D.由 X、Y、Z、M 四种元素共同形成的化合物中一定有共价键,可能有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.把在空气中久置的铝片 5.4g 投入盛有 500mL0.5molL-1 盐酸溶液的烧杯中该铝片与盐酸反应产生氢气的速率与反应时间可用如图所示的坐标曲线来表示,回答下列问题:

(1)曲线由 0→a 段不产生氢气的原因______, 用离子方程式表示为______;
(2)曲线由 b→c 段产生氢气的速率增加较快的主要原因______。
(3)向溶液中加入下列物质,能加快上述化学反应速率的是______。
A 蒸馏水 B 改用铝粉 C 饱和氯化钠溶液 D 浓盐酸 E 少量硫酸铜溶液.
Ⅱ.在 2 L 密闭容器中,800 ℃时反应 2NO+O2![]() 2NO2 体系中,n(NO)随时间的变化如下表:
2NO2 体系中,n(NO)随时间的变化如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(4)如图表示各物质浓度的变化曲线,B 点处,v(正)_______v(逆),(用“大于”“小于”或“等于”填空)。

(5)能说明该反应已经达到平衡状态的是______。
a 容器内压强保持不变 b v(NO)=2v(O2)
c 容器内的密度保持不变 d 2v逆(NO2)=v正(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于反应热和热化学反应的描述中正确的是
A. HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则CH3COOH和NaOH反应的中和热ΔH=-57.3 kJ·mol-1
B. CO(g)的燃烧热是283.0 kJ·mol-1,则反应2CO(g)+O2(g)===2CO2(g)的ΔH=+2×283.0 kJ·mol-1
C. 氢气的燃烧热为285.5 kJ·mol-1,则电解水的热化学方程式为2H2O(l)![]() 2H2(g)+O2(g) ΔH=+2×285.5 kJ·mol-1
2H2(g)+O2(g) ΔH=+2×285.5 kJ·mol-1
D. 1 mol甲烷燃烧生成气态水和二氧化碳时所放出的热量是甲烷的燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三聚氰胺含氮量较高,但对人体有害。一些不法乳制品企业为了提高乳制品中蛋白质含量,向乳制品中添加三聚氰胺,使儿童患肾结石。下图所示的实验装置可用来测定三聚氰胺的分子式。

已知三聚氰胺的相对分子质量为126。取1.26 g三聚氰胺样品,放在纯氧中充分燃烧,生成CO2、H2O、N2,实验测得装置B增重0.54 g,C增重1.32 g,排入F中水的体积为672 mL(可按标准状况计算)。
(1)E装置的作用是________________________。
(2)需要加热的装置是____________(填字母)。
(3)装置D的作用是_________________________。
(4)F处读数时应该注意:_________________、__________________。
(5)三聚氰胺的分子式为___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2和 I2在一定条件下能发生反应:H2(g)+I2(g)![]() 2HI(g),1 mol H2 完全反应放出 akJ热量。已知:(a、b、c 均大于零)。下列说法不正确的是
2HI(g),1 mol H2 完全反应放出 akJ热量。已知:(a、b、c 均大于零)。下列说法不正确的是
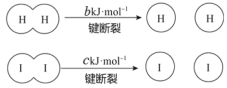
A.反应物的总能量高于生成物的总能量
B.断开 1 mol H—H 键和 1 mol I—I 键所需能量大于断开 2 mol H—I 键所需能量
C.断开 2 mol H—I 键所需能量约为(c+b+a)kJ
D.向密闭容器中加入 2 mol H2 和 2 mo l I2,充分反应放出的热量小于 2a kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com