
【题目】X、Y、Z、M、W 为五种短周期元素,X、Y、Z 是原子序数依次递增的同周期元素,且最外层电子数之和为 15;X 与 Z 可形成 XZ2 分子;Y 与 M 形成的气态化合物在标准状态下的密度为 0.76 g·L-1;W 的质子数是 X、Y、Z、M 四种元素质子数之和的 1/2。下列说法正确的是( )
A.原子半径:W>X>Y>Z>M
B.XZ2、X2M2、W2Z2 均为直线形的共价化合物
C.CaM2 和 CaZ2 两种化合物中,阳离子与阴离子个数比均为 1∶2
D.由 X、Y、Z、M 四种元素共同形成的化合物中一定有共价键,可能有离子键
【答案】AD
【解析】
X、Y、Z、M、W为五种短周期元素,Y与M形成的气态化合物在标准状况下的密度为0.76gL-1,该化合物的摩尔质量为0.76gL-1×22.4L/mol=17g/mol,考虑为NH3,X、Y、Z是原子序数依次递增的同周期元素,故Y为N元素,M为H元素;X与Z可形成XZ2分子,则X位于偶数族,X、Y、Z原子最外层电子数之和为15,故X、Z的最外层电子数之和为15-5=10,Z最外层电子数为偶数,二者平均最外层电子数为5,故Z处于第ⅥA族,X处于第ⅣA族,所以X为C元素,Z为O元素;W的质子数是X、Y、Z、M四种元素质子数之和的![]() ,推出W的质子数为
,推出W的质子数为![]() (6+7+8+1)=11,所以W为Na元素,据此分析解答问题。
(6+7+8+1)=11,所以W为Na元素,据此分析解答问题。
A.同周期自左向右原子半径减小,同主族自上到下原子半径增大,故原子半径Na>C>N>O>H,即W>X>Y>Z>M,A选项正确;
B.XZ2、X2M2、W2Z2分别为CO2、Na2O2,CO2、C2H2均为直线型共价化合物,但Na2O2为离子化合物,B选项错误;
C.CaH2在阳离子与阴离子个数比为1:2,而CaO2中阳离子与阴离子个数比为1:1,C选项错误;
D.由C、N、O、H四种元素形成的化合物一定有共价键,可能含有离子键,如NH4HCO3中既含有共价键,又含有离子键,D选项正确;
答案选AD。


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】下列各步制取物质,最终无法达到目的的有
A. Al![]() Al2O3
Al2O3![]() Al(NO3)3
Al(NO3)3![]() Al(NO3)3晶体
Al(NO3)3晶体
B. Cu![]() CuO
CuO![]() CuSO4溶液
CuSO4溶液![]() CuSO4·5H2O
CuSO4·5H2O
C. Fe![]() FeCl3
FeCl3![]() Fe(OH)3
Fe(OH)3![]() Fe2O3
Fe2O3
D. CuSO4溶液![]() CuS
CuS![]() CuS
CuS
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我们可以从海水中可制取许多化工原料。以下是某化工厂对海水加工的示意图:
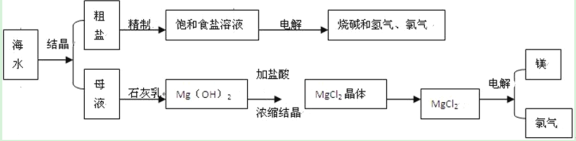
根据以上工艺流程回答下列问题:
(1)饱和食盐水被电解的化学方程式______。
(2)海水结晶过滤的母液中含有 K+ 、 Na+ 、 Mg2+等阳离子,从图中可看出对母液进行一系列的加工可制得金属镁。
①充分考虑当地海洋化学资源,从提高生产与经济效益的角度考虑,生产生石灰的主要原料是_______。
②熔融氯化镁电解制镁的化学方程式是______。
③生产过程所得的镁蒸气在特定的环境里冷却后可得固态的金属镁,下列物质中可以用作镁蒸气的冷却剂的是(填写代号)_______。
A.空气 B.Ar C.H2 D.CO2
(3)在该化工厂中,海水提取氯化钠后的母液经过提取氯化镁后又形成了新的母液,向新母液中加入氯气,又制取了重要的化工原料溴单质
①生成溴单质的化学反应的化学方程式是______,从溴苯混合物中分离出溴单质来应采用______(填实验方法)。
②获取生产单质溴的原料氯气,以下设想合理的是______(填写代号).
A 本厂生产镁单质处循环 B 从本厂生产烧碱处循环
C 在当地新建生产厂 D 从外地购买
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在 2 L 密闭容器中,A、B、C 三种气体的物质的量随时间变化的曲线如图所示。下列说法正确的是( )
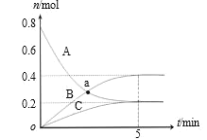
A.反应开始到 5min,υ(C)=0.2 mol/(L·min)
B.反应开始到 5min,B 的物质的量浓度增加了 0.4 mol/L
C.反应的化学方程式为:2B(g)+C(g)![]() 3A(g)
3A(g)
D.a 点时,c(A)=c(B)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次氯酸锂稳定性远髙于次氯酸钠,也可用于杀菌消毒。制备次氯酸锂方法较多,常用的一种合成路线如图:
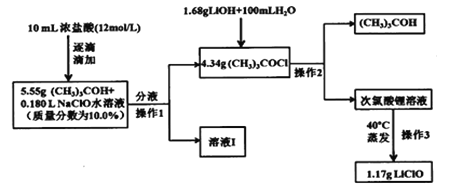
已知:1.次氯酸叔丁酯((CH3)3COCl),相对分子质量为108.5,是具有挥发性的黄色油状液体,密度为0.802g/mL,且有强烈刺激性臭味;
2.(CH3)3COCl+LiOH=LiClO+(CH3)3COH
请回答:
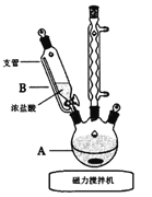
(1)实验第一步的反应装置如图所示(夹持装置省略),①B装置中支管的作用是________;②浓盐酸逐滴滴加而不是一次性加入的原因是__________。
(2)请写出在装置A中发生反应的化学方程式______________。
(3)进行操作3时,并不是直接加热蒸发溶液,而是选择在40°C下缓慢蒸发溶液,试解释其原因___________。
(4)该实验中次氯酸锂的产率为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 银锌纽扣电池的放电反应:Zn+Ag2O+H2O=Zn(OH)2+2Ag,其中Ag2O作正极,发生还原反应
B. 通过构成原电池,能将反应的化学能全部转化为电能
C. 如图原电池中,电池工作时,SO42-移向电池的正极
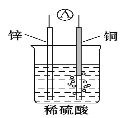
D. 构成原电池的两个电极必须是活泼性不同的两种金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是一种重要的元素,其对应化合物在生产生活中有重要的应用。
(1)氮化铝(AlN)可用于制备耐高温的结构陶瓷,遇强碱会腐蚀,写出AlN与氢氧化钠溶液反应的离子方程式_____。
(2)氨是制备氮肥、硝酸等的重要原料
①已知:N2(g)+3H2(g) ![]() 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
N2(g)+O2(g) ![]() 2NO(g) △H=+180 kJ/mol
2NO(g) △H=+180 kJ/mol
2H2(g)+O2(g) ![]() 2H2O(1) △H= -571.6 kJ/mol
2H2O(1) △H= -571.6 kJ/mol
试写出表示氨的标准燃烧热的热化学方程式_____。
②某电解法制氨的装置如图所示,电解质只允许质子通过,试写出阴极的电极反应式_____。
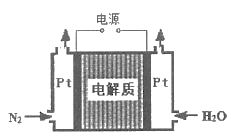
(3)反应:2NO(g)+O2(g) ![]() 2NO2(g)△H<0 是制备硝酸过程中的一个反应。
2NO2(g)△H<0 是制备硝酸过程中的一个反应。
①将NO和O2按物质的量之比为 2:1 置于恒温恒容密闭容器中进行上述反 应,得到NO2 体积分数与时间的关系如图所示。保持其它条件不变,t1 时再向 容器中充入适量物质的量之比为2:1的NO和O2的混合气体,t2 时再次达到平 衡,请画出 tl-t3 时间范围内 NO2 体积分数随时间的变化曲线:_________。

②在研究此反应速率与温度的关系时发现,NO 转化成 NO2 的速率随温度升高反而减慢。进一步研究发现,上述反应实际是分两步进行的:
I.2NO(g) ![]() N2O2(g) △H<0
N2O2(g) △H<0
II.N2O2(g)+O2(g) ![]() 2NO2(g) △H<0
2NO2(g) △H<0
已知反应I能快速进行,试结合影响化学反应速率的因素和平衡移动理论分析,随温度升高,NO 转化成 NO2 的速率减慢的可能原因________。
(4)已知常温下,Ka(CH3COOH)=Kb(NH3·H2O)=l.8×l0-5。则常温下 0.lmol/L 的 CH3COONH4 溶液中,c(CH3COO-):c(NH3·H2O)=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素R、T、X、Y、Z在元素周期表中的相对位置如图所示,其中Z单质与H2混合遇强光会发生爆炸。则下列判断错误的是

A.气态氢化物的沸点:H2T>H2Y>H2R
B.R与Y的电子数相差8
C.非金属性:Z>Y>X
D.Z的含氧酸的酸性比Y的强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com