
【题目】我们可以从海水中可制取许多化工原料。以下是某化工厂对海水加工的示意图:
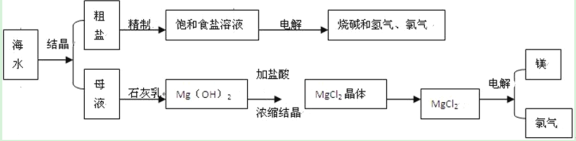
根据以上工艺流程回答下列问题:
(1)饱和食盐水被电解的化学方程式______。
(2)海水结晶过滤的母液中含有 K+ 、 Na+ 、 Mg2+等阳离子,从图中可看出对母液进行一系列的加工可制得金属镁。
①充分考虑当地海洋化学资源,从提高生产与经济效益的角度考虑,生产生石灰的主要原料是_______。
②熔融氯化镁电解制镁的化学方程式是______。
③生产过程所得的镁蒸气在特定的环境里冷却后可得固态的金属镁,下列物质中可以用作镁蒸气的冷却剂的是(填写代号)_______。
A.空气 B.Ar C.H2 D.CO2
(3)在该化工厂中,海水提取氯化钠后的母液经过提取氯化镁后又形成了新的母液,向新母液中加入氯气,又制取了重要的化工原料溴单质
①生成溴单质的化学反应的化学方程式是______,从溴苯混合物中分离出溴单质来应采用______(填实验方法)。
②获取生产单质溴的原料氯气,以下设想合理的是______(填写代号).
A 本厂生产镁单质处循环 B 从本厂生产烧碱处循环
C 在当地新建生产厂 D 从外地购买
【答案】2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑ 贝壳 MgCl2(熔融)
2OH-+H2↑+Cl2↑ 贝壳 MgCl2(熔融) ![]() Mg+Cl2↑ BC Cl2+2Br-=Br2+2Cl- 蒸馏 AB
Mg+Cl2↑ BC Cl2+2Br-=Br2+2Cl- 蒸馏 AB
【解析】
(1)电解食盐水生成氢氧化钠、氢气、氯气,反应的离子方程式是2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑,故答案为:2Cl-+2H2O
2OH-+H2↑+Cl2↑,故答案为:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑;
2OH-+H2↑+Cl2↑;
(2)①碳酸钙高温分解生成氧化钙,贝壳的主要成分是碳酸钙,所以从充分利用当地海洋化学资源,提高生产与经济效益的角度考虑,生产生石灰的主要原料是贝壳,故答案为:贝壳;
②电解熔融氯化镁生成镁和氯气,反应的化学方程式是MgCl2(熔融) ![]() Mg+Cl2↑,故答案为:MgCl2(熔融)
Mg+Cl2↑,故答案为:MgCl2(熔融) ![]() Mg+Cl2↑;
Mg+Cl2↑;
③A.镁与空气的氧气、氮气都能反应,所以镁蒸气不能在空气的环境里冷却,A不选;
B.Ar的化学性质稳定,镁蒸气不与Ar发生反应,可用Ar作镁蒸气的冷却剂,B选;
C.镁蒸气、H2都具有还原性,不反应,所以镁蒸气在氢气的环境里冷却后可得固态的金属镁,C选;
D.镁蒸气会与CO2发生反应生成MgO,所以镁蒸气不能在CO2的环境里冷却,D不选;
故答案为:BC。
(3)①向新母液中加入氯气,制取溴单质,反应方程式是Cl2+2Br-=Br2+2Cl-,溴和苯的沸点差异较大,因此从溴苯混合物中分离出溴单质可采用蒸馏的方法,故答案为:Cl2+2Br-=Br2+2Cl-;蒸馏;
②从节约成本、提高综合效益的角度,生产溴单质所用的氯气,可以从本厂生产烧碱外循环,也可以从本厂生产镁单质处循环,选AB,故答案为:AB。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】铬酸铅(PbCrO4)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( )
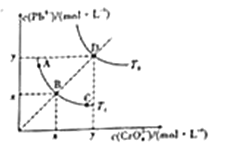
A. 图中x和y分别为T1,T2温度下PbCrO4在水中的溶解度
B. 图中各点对应的Ksp的关系为Ksp(A)=Ksp(C)<Ksp(B)<Ksp(D)
C. 向A点的溶液中加入少量Na2CrO4固体,溶液组成由A沿ABC线向B方向移动
D. 温度降低时,D点的饱和溶液的组成由D沿DB线向B方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸镍是一种重要的化工中间体,是镍行业研究的热点。一种以石油化工中的废镍催化剂(主要成分为NiCO3和SiO2,还含有少量Fe2O3、Cr2O3)为原料制备硫酸镍的工业流程如图:

已知:Ⅰ.NiS、Ni(OH)2、Cr(OH)3均难溶于水,Cr(OH)3是两性氢氧化物;
Ⅱ.Fe(OH)3不溶于NH4Cl-氨水的混合液,Ni(OH)2溶于NH4Cl-氨水的混合液生成[Ni(NH3)6]2+。
请回答下列问题:
(1)“酸溶”时应先将废镍催化剂粉碎,再与20%硫酸在100℃下反应2h,该操作的目的为____。
(2)“滤渣Ⅰ”的主要成分为___(填化学式),该物质在工业上的用途为___(任写一种)。
(3)“一次碱析”时,加入的NaOH溶液需过量,含铬微粒发生反应的离子方程式为__。
(4)“氨解”的目的为___。“净化”时通入H2S的目的是___。
(5)“氧化”时发生反应的离子方程式为___。
(6)“系列操作”具体是指____、过滤、洗涤、干燥。若所得NiSO4·7H2O晶体不纯,应继续进行的提纯操作名称为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一刚性密闭容器内部有一不漏气且可滑动的活塞将容器分成左右两个室,左室内充入一定体积的CO和H2O气体,右室充入SO2和O2两种气体,且SO2和O2的物质的量之比为2:1,左右两室内各可发生如下反应:
左室 CO(气)+H2O(气) ![]() CO2(气)+H2(气)△H<0
CO2(气)+H2(气)△H<0
右室 2SO2(气)+O2(气) ![]() 2SO3(气) △H<0
2SO3(气) △H<0
反应开始时活塞停留在离左端点3/7处,反应在恒温下进行,当达平衡状态时,活塞处于容器中间。下列叙述正确的是
![]()
A. 右室气体反应前后的压强之比为4:3
B. 反应达平衡时气体SO2的转化率为75%
C. 平衡时再向左室中充入与原物质的量之比相同的CO和H2O气体,达平衡时,CO的物质的量分数不变 ,SO2的物质的量分数变大
D. 若原容器中左右两室起始时充入的各物质的量均为原来的两倍,达平衡时,活塞相对于中间位置将偏左
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究元素周期律。甲同学设计了如图1装置,根据元素非金属性与对应最高价含氧酸之间的关系,可以一次性完成碳族元素中C与Si的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律。A、B、C三处分别是蘸有NaBr溶液的棉花、湿润的淀粉KI试纸、蘸有碱液的棉花。已知常温下浓盐酸与高锰酸钾能反应生成氯气。
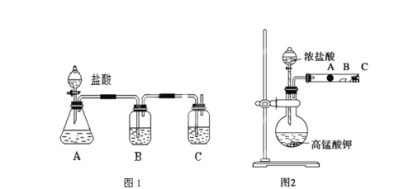
(1)根据实验图1作答:
①写出选用试剂分别 B__________,C____________
②装置B中所盛试剂的作用为_________
③C中反应的离子方程式为_______
④从实验所得非金属性C____Si(填“大于”或“小于”)
(2)根据实验图2作答:
①写出 A处的离子方程式:_______
②B处的现象_____
③C处药品的作用 _______。
④通过图2 装置实验得出同主族元素性质的递变规律为___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼元素为人体及动植物必须的微量元素,也在钢铁工业中的有着重要的作用,钼作为钢的合金化元素,可以提高钢的强度,特别是高温强度和韧性。我国钼元素的储量丰富,在世界上占第二位。如图所示是钼元素的相关信息,下列有关钼的说法错误的是

A.95Mo18O42-(钼酸根离子)中共计有 76 个电子
B.95Mo 的相对原子质量是 95.96
C.92Mo、95Mo、98Mo 互为同位素,化学性质几乎相同
D.98Mo 的原子核内有 56 个中子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、W 为五种短周期元素,X、Y、Z 是原子序数依次递增的同周期元素,且最外层电子数之和为 15;X 与 Z 可形成 XZ2 分子;Y 与 M 形成的气态化合物在标准状态下的密度为 0.76 g·L-1;W 的质子数是 X、Y、Z、M 四种元素质子数之和的 1/2。下列说法正确的是( )
A.原子半径:W>X>Y>Z>M
B.XZ2、X2M2、W2Z2 均为直线形的共价化合物
C.CaM2 和 CaZ2 两种化合物中,阳离子与阴离子个数比均为 1∶2
D.由 X、Y、Z、M 四种元素共同形成的化合物中一定有共价键,可能有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于反应热和热化学反应的描述中正确的是
A. HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则CH3COOH和NaOH反应的中和热ΔH=-57.3 kJ·mol-1
B. CO(g)的燃烧热是283.0 kJ·mol-1,则反应2CO(g)+O2(g)===2CO2(g)的ΔH=+2×283.0 kJ·mol-1
C. 氢气的燃烧热为285.5 kJ·mol-1,则电解水的热化学方程式为2H2O(l)![]() 2H2(g)+O2(g) ΔH=+2×285.5 kJ·mol-1
2H2(g)+O2(g) ΔH=+2×285.5 kJ·mol-1
D. 1 mol甲烷燃烧生成气态水和二氧化碳时所放出的热量是甲烷的燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PbCO3广泛用于陶瓷、油漆和颜料配制等。一种由方铅矿(主要成分为PbS,含少量FeS)和软锰矿(主要成分为MnO2)为原料制备PbCO3的流程如图:
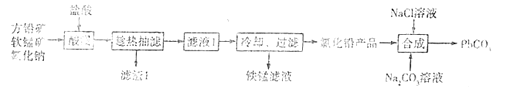
已知:①“酸浸”时PbS反应的方程式为PbS+MnO2+4Cl-+4H+=== PbCl42-+Mn2++S+2H2O。PbCl2易溶于热水,难溶于冷水。在盐酸中因与Cl-形成配合离子PbCl42-而增大PbCl2的溶解度.
②常温下,几种金属离子沉淀的pH如表:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
开始沉淀的pH | 1.5 | 7.5 | 8.8 |
完全沉淀的pH | 2.3 | 9.7 | 10.4 |
(1)“酸浸”之前需要将方铅矿、软锰矿和氧化钠粉碎并混合均匀,其目的是____。
(2)“趁热抽滤”的目的是___。
(3)铁锰滤液中阳离子主要是Mn2+,还含少量Fe3+、Fe2+。从铁锰滤液中得到较纯锰盐溶液有两种方案:
方案甲:向滤液中加入酸化的双氧水,再加入足量MnCO3粉末,过滤得到锰盐溶液。
方案乙:向滤液中加入稀硫酸酸化,然后加入二氧化锰粉末,充分反应;最后,加氨水调节溶液pH,过滤。
①方案甲中加入MnCO3的目的是_____。
②用离子方程式表示方案乙中“加入二氧化锰”的作用:____。
已知常温下,Ksp[Fe(OH)3]≈1.0×10-38,为了使溶液中c(Fe3+)=1.0×10-5mol·L-1,此时溶液的pH= ____。
③从操作、产品纯度角度考虑,方案____(填“甲”或”乙”)优于另一种方案。
(4)研究工业生产中温度对浸出率的影响如图所示,则生产中浸出过程的最佳温度是___。
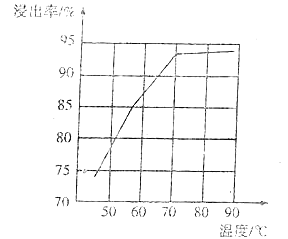
(5)向氯化铅(难溶于水)产品中加入氯化钠溶液和碳酸钠溶液,得到碳酸铅产品后,要经过“过滤、洗涤、干燥”等操作,检验碳酸铅是否洗涤干净的操作是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com