
【题目】铬酸铅(PbCrO4)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( )
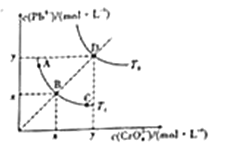
A. 图中x和y分别为T1,T2温度下PbCrO4在水中的溶解度
B. 图中各点对应的Ksp的关系为Ksp(A)=Ksp(C)<Ksp(B)<Ksp(D)
C. 向A点的溶液中加入少量Na2CrO4固体,溶液组成由A沿ABC线向B方向移动
D. 温度降低时,D点的饱和溶液的组成由D沿DB线向B方向移动
科目:高中化学 来源: 题型:
【题目】现有一种制取铜和其他产物的新工艺,原料的综合利用率较高。其主要流程如下:
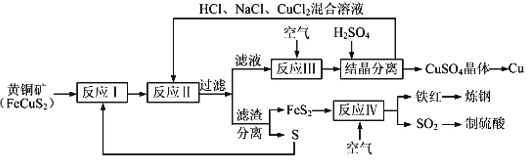
注:反应Ⅱ的离子方程式为Cu2++CuS+4Cl﹣=2[CuCl2]﹣+S
请回答下列问题:
(1)传统工艺制铜是将铜矿砂与空气在高温下煅烧,使这种方法的缺点是要消耗大量的热能以及____________________________(完成合理的一种即可)。
(2)为使反应Ⅰ中充分进行,工业可采取的措施是_________(完成合理的一种即可),反应Ⅰ的产物为(填化学式) ___________________。
(3)反应Ⅲ的离子方程式为______________________________________,一定温度下,在反应Ⅲ所得的溶液中加入稀硫酸,可以析出硫酸铜晶体,其可能的原因是____________________________。
(4)工业上炼钢时,为了降低含碳量,可将铁红投入熔融的生铁(含碳量大于2%的铁碳合金)中,该过程中主要反应的化学方程式是___________________________________。
(5)某硫酸厂为测定反应Ⅳ所得气体中SO2的体积分数,取560mL(已折算成标准状况)气体样品与足量Fe2(SO4)3溶液完全反应后,用浓度为0.02000molL﹣1的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液50.00mL。
已知Cr2O72﹣+Fe2++H+→Cr3++Fe3++H2O(未配平)
①SO2通入Fe2(SO4)3溶液,发生反应的离子方程式为 ____________________________ 。
②反应Ⅳ所得气体中SO2的体积分数为_________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铝主要用作造纸工业中的沉淀剂和饮用水的絮凝剂。用铝灰(Al2O3、SiO2和少量铁的氧化物)制备硫酸铝晶体[Al2(SO4)3·18H2O]的工艺流程如图所示:
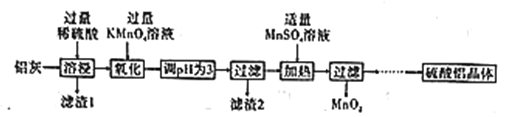
(1)滤渣1的化学式为____。
(2)“氧化”步骤的离子方程式为____。
(3)已知:相关离子生成氢氧化物沉淀的pH范围如表:
Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀时 | 3.4 | 6.3 | 1.5 |
完全沉淀时 | 4.7 | 8.3 | 2.8 |
根据表中数据解释调节pH为3的目的是________。
(4)“加热”步骤中反应的生成物中氧化产物与还原产物的物质的量之比为_____。
(5)“…”中一系列操作是___、冷却结晶、过滤、___、干燥。
(6)硫酸铝晶体加热发生分解的失重曲线如图所示,主要分为三个阶段:第一阶段失重40.54%,第二阶段失重48.65%,第三阶段失重84.68%,以后不再失重。
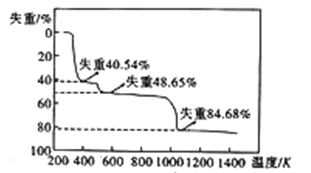
①失重第一阶段残留固体的化学式为_________。
②失重第三阶段反应的化学方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)难溶物PbSO4溶于CH3COONH4溶液可制得易溶于水的(CH3COO)2Pb,发生的反应为PbSO4+2CH3COONH4=(CH3COO)2Pb+(NH4)2SO4,说明(CH3COO)2Pb是________(填“强”或“弱”)电解质。
(2)已知次磷酸(H3PO2)与足量的氢氧化钠溶液反应生成NaH2PO2和H2O,则次磷酸是_____元酸(填“一”、“二”或“三”)。
(3)工业上制玻璃和水泥需用到的共同原料是________(填化学式)。
(4)在一定温度下,向一个2 L的真空密闭容器中(预先装入催化剂)通入1 mol N2和3 mol H2,发生反应:N2(g)+3H2(g)2NH3(g)。经过一段时间后,测得容器内压强是起始的0.9倍,在此时间内,H2平均反应速率为0.1 mol/(L·min),则所经过的时间为______min
(5)高铁酸钠(Na2FeO4)具有强氧化性,可对自来水进行消毒、净化。高铁酸钠可用氢氧化铁和次氯酸钠在碱性介质中反应得到,请补充并配平下面离子方程式。
____Fe(OH)3 +____ClO-+____OH-=__FeO42-+___Cl-+__
(6)在反应11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中,氧化剂是___________;当有2mol H3PO4生成,转移的电子的物质的量为___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取 1LFeCl3 溶液腐蚀铜板制作电路板,反应后在此残留液中慢慢加入铁粉,溶液中 Fe2+的浓度变化如图所示(加入固体引起的体积变化忽略不计),下列说法不正确的是

A. 当n(Fe)=0.5mol 时,发生的离子反应为 Fe+2Fe3+=3Fe2+
B. 当 n(Fe)=1.5mol 时,溶液中发生的总反应离子方程式为4Fe3++Cu2++3Fe=7Fe2++Cu
C. 当n(Fe)=1mol 时,溶液中 c(Fe2+)=5 mol·L-1
D. 腐蚀之前原溶液中 c(Fe3+)=4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某中性有机物A的分子量为88,碳的质量分数为54.5%,氢的质量分数为9.1%,其余为氧。可发生如图所示变化:
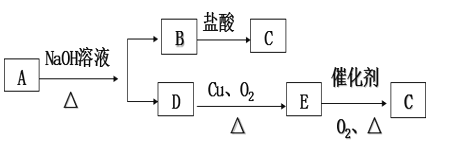
(1)C中官能团的名称是__________ 。
(2)D→E的反应类型是____________。
(3)有机物A与氢氧化钠溶液反应的化学方程式为___________。
(4)已知某烃X的相对分子质量比A小16,分子中碳与氢的质量之比为5:1。下列说法正确的是________。
A.相同条件下X的密度比水小
B. 烃X能与氢气发生还原反应
C.甲烷与烃X互为同系物
D.C、D、E可用新制氢氧化铜检验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我们可以从海水中可制取许多化工原料。以下是某化工厂对海水加工的示意图:
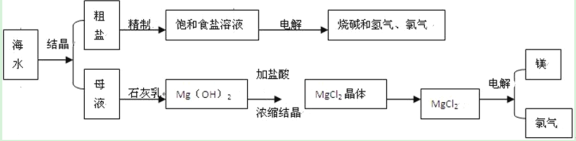
根据以上工艺流程回答下列问题:
(1)饱和食盐水被电解的化学方程式______。
(2)海水结晶过滤的母液中含有 K+ 、 Na+ 、 Mg2+等阳离子,从图中可看出对母液进行一系列的加工可制得金属镁。
①充分考虑当地海洋化学资源,从提高生产与经济效益的角度考虑,生产生石灰的主要原料是_______。
②熔融氯化镁电解制镁的化学方程式是______。
③生产过程所得的镁蒸气在特定的环境里冷却后可得固态的金属镁,下列物质中可以用作镁蒸气的冷却剂的是(填写代号)_______。
A.空气 B.Ar C.H2 D.CO2
(3)在该化工厂中,海水提取氯化钠后的母液经过提取氯化镁后又形成了新的母液,向新母液中加入氯气,又制取了重要的化工原料溴单质
①生成溴单质的化学反应的化学方程式是______,从溴苯混合物中分离出溴单质来应采用______(填实验方法)。
②获取生产单质溴的原料氯气,以下设想合理的是______(填写代号).
A 本厂生产镁单质处循环 B 从本厂生产烧碱处循环
C 在当地新建生产厂 D 从外地购买
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com