
【题目】硫酸铝主要用作造纸工业中的沉淀剂和饮用水的絮凝剂。用铝灰(Al2O3、SiO2和少量铁的氧化物)制备硫酸铝晶体[Al2(SO4)3·18H2O]的工艺流程如图所示:
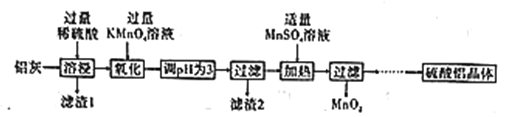
(1)滤渣1的化学式为____。
(2)“氧化”步骤的离子方程式为____。
(3)已知:相关离子生成氢氧化物沉淀的pH范围如表:
Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀时 | 3.4 | 6.3 | 1.5 |
完全沉淀时 | 4.7 | 8.3 | 2.8 |
根据表中数据解释调节pH为3的目的是________。
(4)“加热”步骤中反应的生成物中氧化产物与还原产物的物质的量之比为_____。
(5)“…”中一系列操作是___、冷却结晶、过滤、___、干燥。
(6)硫酸铝晶体加热发生分解的失重曲线如图所示,主要分为三个阶段:第一阶段失重40.54%,第二阶段失重48.65%,第三阶段失重84.68%,以后不再失重。
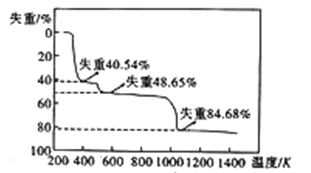
①失重第一阶段残留固体的化学式为_________。
②失重第三阶段反应的化学方程式为_________。
【答案】SiO2 5Fe2++MnO4-+8H+===5Fe3++Mn2++4H2O 使Fe3+完全沉淀,而Al3+不沉淀,将Fe3+除去 3:2 蒸发(或加热)浓缩 洗涤 Al2(SO4)3·3H2O Al2(SO4)3![]() Al2O3+3SO3↑
Al2O3+3SO3↑
【解析】
用含有Al2O3、SiO2和少量铁的氧化物的铝灰制备Al2(SO4)318H2O,结合流程可知,水洗过滤,再加硫酸得到的固体为SiO2,滤液中含Al3+、Fe3+、Fe2+,加入KMnO4或H2O2等氧化剂是把Fe2+氧化为Fe3+,调pH目的是使Fe3+生成Fe(OH)3沉淀而除去,加入MnSO4,依据溶液紫红色消失及产物,可知MnSO4与KMnO4发生反应生成MnO2沉淀而除去MnO4-,滤液含Al2(SO4)3,蒸发浓缩、冷却结晶得到Al2(SO4)318H2O,以此来解答。
(1)铝灰的成分中只有SiO2不与硫酸反应,因此,滤渣1为SiO2;
(2)加入高锰酸钾的作用是将二价铁氧化为三价铁,离子反应方程式为:5Fe2++MnO4-+8H+===5Fe3++Mn2++4H2O;
(3)为使Fe3+完全沉淀,而Al3+不沉淀,将Fe3+除去,根据表格中数据,溶液的pH值为3;
(4)加入MnSO4,依据溶液紫红色消失,可知MnSO4与KMnO4发生反应生成MnO2沉淀而除去MnO4,溶液呈酸性配平电荷时用H+配平,离子反应为:
3Mn2++2MnO4+2H2O═5MnO2↓+4H+,根据方程式可得还原剂为Mn2+,氧化剂为MnO4,MnO2既是氧化产物又是还原产物。生成物中氧化产物与还原产物的物质的量之比为3:2;
(5)又溶液变为晶体操作方法为蒸发(或加热)浓缩、冷却结晶、过滤、洗涤、干燥。
(6)硫酸铝晶体中结晶水的含量为![]() ×100%=48.65%,故第二阶段完全失去结晶水,得到的物质为Al2(SO4)3,第一阶段失去部分结晶水,失去结晶水数目为666×40.54%÷18=15,故第一阶段得到的物质为Al2(SO4)3·3H2O,第三阶段剩余物质的相对分子质量为666×(1-84.68%)=102,应是Al2O3,故反应方程式为Al2(SO4)3
×100%=48.65%,故第二阶段完全失去结晶水,得到的物质为Al2(SO4)3,第一阶段失去部分结晶水,失去结晶水数目为666×40.54%÷18=15,故第一阶段得到的物质为Al2(SO4)3·3H2O,第三阶段剩余物质的相对分子质量为666×(1-84.68%)=102,应是Al2O3,故反应方程式为Al2(SO4)3![]() Al2O3+3SO3↑。
Al2O3+3SO3↑。


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】某个体小煤矿曾发生瓦斯爆炸事故,造成人员伤亡。在煤矿矿井里,必须采取安全措施,如通风、严禁烟火等,而且要随时检查瓦斯的体积分数,如果空气中含甲烷的体积分数为5%~15.4%,遇到明火会发生爆炸。发生最强烈爆炸时空气中甲烷所占的体积分数约是
A. 5% B. 9.1% C. 10.5% D. 15%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以A(C2H2)为原料合成食用香料E和吡咯(pyrrole)的路线如图所示,部分反应条件及产物略去。其中D在一定条件下可被氧化成酮。
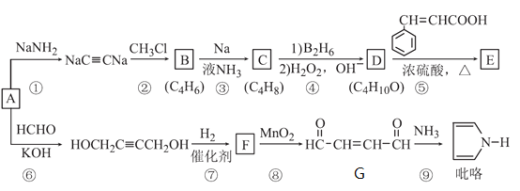
回答下列问题:
(1)A的官能团名称是_______________;C的名称是_______________;
(2)⑥的反应类型是_______________。⑧的反应类型是_______________。
(3)反应⑤的化学方程式为____________________________。
(4)满足下列条件的肉桂酸(![]() )的同分异构体共有_________种(不考虑立体异构):①含有苯环 ②能让溴的四氯化碳溶液褪色 ③能水解。与G互为同分异构体,且核磁共振氢谱只有一组峰的有机物的结构简式是________。(任写一种)
)的同分异构体共有_________种(不考虑立体异构):①含有苯环 ②能让溴的四氯化碳溶液褪色 ③能水解。与G互为同分异构体,且核磁共振氢谱只有一组峰的有机物的结构简式是________。(任写一种)
(6)参照上述合成路线,设计一条由A和乙醛为起始原料制备2,5-二甲基吡咯(![]() )的合成路线_________________________________。
)的合成路线_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值。下列说法正确的是
A.15g 14CO与15N2的混合气体所含质子数为7.5NA
B.11.2L Cl2与NaOH溶液反应,转移电子数为0.5NA
C.2mol SO2与1mol O2反应生成SO3的分子数为2NA
D.6g MgSO4与NaHSO4的混合物所含氧原子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 Q、W、X、Y、Z原子序数依次增加,其中Q、W原子核外L 电子层的电子数分别为0、4,X、Y、Z在周期表中的位置如图所示。 下列说法不正确的是
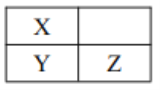
A. W、 X、 Q 的原子半径依次减小 B. Y 的最高价氧化物的水化物一定是强酸
C. W 和 Z 可能形成化合物W3Z8 D. Q、 X、 Z 可能形成离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有4支试管中分别进行如下表所示实验,结论正确的是( )
选项 | 操作 | 现象 | 结论 |
A | 滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH |
B | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+、无K+ |
C | 滴加氯水和CCl4,振荡,静置 | 下层溶液显紫色 | 原溶液中有I- |
D | 通入过量CO2气体 | 生成白色沉淀 | 原溶液中只有AlO |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬酸铅(PbCrO4)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( )
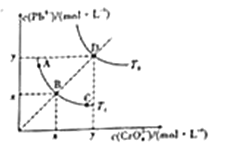
A. 图中x和y分别为T1,T2温度下PbCrO4在水中的溶解度
B. 图中各点对应的Ksp的关系为Ksp(A)=Ksp(C)<Ksp(B)<Ksp(D)
C. 向A点的溶液中加入少量Na2CrO4固体,溶液组成由A沿ABC线向B方向移动
D. 温度降低时,D点的饱和溶液的组成由D沿DB线向B方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氯原子的质量是a g ,12C原子的质量是b g ,用NA表示阿佛加德罗常数,下列说法中正确的是( )
①氯元素的相对原子质量一定是![]() ② m g该氯原子的物质的量一定是
② m g该氯原子的物质的量一定是![]() mol③该氯原子的摩尔质量是aNA g/ mol④ a g该氯原子所含质子数是17NA
mol③该氯原子的摩尔质量是aNA g/ mol④ a g该氯原子所含质子数是17NA
A. ①③B. ①④C. ②③D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一刚性密闭容器内部有一不漏气且可滑动的活塞将容器分成左右两个室,左室内充入一定体积的CO和H2O气体,右室充入SO2和O2两种气体,且SO2和O2的物质的量之比为2:1,左右两室内各可发生如下反应:
左室 CO(气)+H2O(气) ![]() CO2(气)+H2(气)△H<0
CO2(气)+H2(气)△H<0
右室 2SO2(气)+O2(气) ![]() 2SO3(气) △H<0
2SO3(气) △H<0
反应开始时活塞停留在离左端点3/7处,反应在恒温下进行,当达平衡状态时,活塞处于容器中间。下列叙述正确的是
![]()
A. 右室气体反应前后的压强之比为4:3
B. 反应达平衡时气体SO2的转化率为75%
C. 平衡时再向左室中充入与原物质的量之比相同的CO和H2O气体,达平衡时,CO的物质的量分数不变 ,SO2的物质的量分数变大
D. 若原容器中左右两室起始时充入的各物质的量均为原来的两倍,达平衡时,活塞相对于中间位置将偏左
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com