
【题目】下列根据反应Zn +Cu2+ =Zn2+ + Cu设计的原电池不符合该反应的是
A. B.
B.
C. D.
D.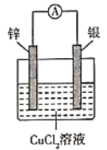
科目:高中化学 来源: 题型:
【题目】下列方程式书写正确的是( )
A. NaHSO4在水溶液中的电离方程式:NaHSO4===Na++HSO4-
B. HF与NaOH溶液反应:H+(aq)+OH-(aq) = H2O(l) ΔH=-57.3 kJ/mol
C. 1g H2燃烧生成液态水放出142.9 kJ的热量,其热化学方程式:2H2(g)+ O 2(g) = 2H2O (l) ΔH = —142.9 kJ·mol-1
D. CaCO3沉淀溶解平衡方程式:CaCO3(s) ![]() Ca2+(aq)+CO32-(aq)
Ca2+(aq)+CO32-(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
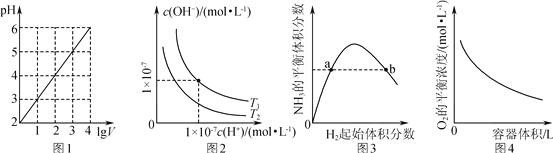
A. 图1表示1 L pH=2的CH3COOH溶液加水稀释至V L,pH随lg V的变化
B. 图2表示不同温度下水溶液中H+和OH-浓度的变化的曲线,图中温度T2>T1
C. 图3表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率小于b点
D. 图4表示同一温度下,在不同容积的容器中进行反应2BaO2(s) ![]() 2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以A(C2H2)为原料合成食用香料E和吡咯(pyrrole)的路线如图所示,部分反应条件及产物略去。其中D在一定条件下可被氧化成酮。
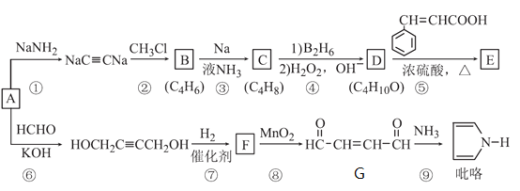
回答下列问题:
(1)A的官能团名称是_______________;C的名称是_______________;
(2)⑥的反应类型是_______________。⑧的反应类型是_______________。
(3)反应⑤的化学方程式为____________________________。
(4)满足下列条件的肉桂酸(![]() )的同分异构体共有_________种(不考虑立体异构):①含有苯环 ②能让溴的四氯化碳溶液褪色 ③能水解。与G互为同分异构体,且核磁共振氢谱只有一组峰的有机物的结构简式是________。(任写一种)
)的同分异构体共有_________种(不考虑立体异构):①含有苯环 ②能让溴的四氯化碳溶液褪色 ③能水解。与G互为同分异构体,且核磁共振氢谱只有一组峰的有机物的结构简式是________。(任写一种)
(6)参照上述合成路线,设计一条由A和乙醛为起始原料制备2,5-二甲基吡咯(![]() )的合成路线_________________________________。
)的合成路线_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A(C3H6)是基本有机化工原料。由A制备聚合物C和![]() 的合成路线(部分反应条件略去)如图所示:
的合成路线(部分反应条件略去)如图所示:
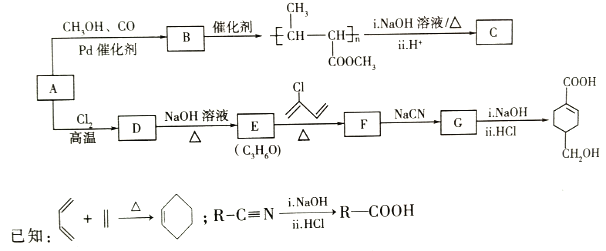
回答下列问题:
(1)D的名称是_______,B含有的含氧官能团的名称是_______________。
(2)C的结构简式为_______________,D→E的反应类型为________________。
(3)E→F的化学方程式为____________________________。
(4)![]() 中最多有__________个原子共平面,
中最多有__________个原子共平面,![]() 发生缩聚反应生成有机物的结构简式为_______________。
发生缩聚反应生成有机物的结构简式为_______________。
(5)B的同分异构体中,与B具有相同的官能团且能发生银镜反应的共有________种;其中核磁共振氢谱为3组峰,且峰面积之比为6:1:1的是__________(写结构简式)。
(6)结合题给信息,以乙烯、HBr为起始原料制备丙酸,设计合成路线。(无机试剂任选,合成路线流程图示例见本题题干) ________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值。下列说法正确的是
A.15g 14CO与15N2的混合气体所含质子数为7.5NA
B.11.2L Cl2与NaOH溶液反应,转移电子数为0.5NA
C.2mol SO2与1mol O2反应生成SO3的分子数为2NA
D.6g MgSO4与NaHSO4的混合物所含氧原子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 Q、W、X、Y、Z原子序数依次增加,其中Q、W原子核外L 电子层的电子数分别为0、4,X、Y、Z在周期表中的位置如图所示。 下列说法不正确的是
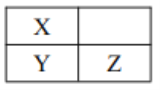
A. W、 X、 Q 的原子半径依次减小 B. Y 的最高价氧化物的水化物一定是强酸
C. W 和 Z 可能形成化合物W3Z8 D. Q、 X、 Z 可能形成离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬酸铅(PbCrO4)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( )
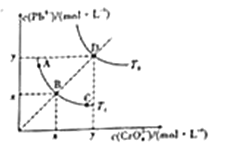
A. 图中x和y分别为T1,T2温度下PbCrO4在水中的溶解度
B. 图中各点对应的Ksp的关系为Ksp(A)=Ksp(C)<Ksp(B)<Ksp(D)
C. 向A点的溶液中加入少量Na2CrO4固体,溶液组成由A沿ABC线向B方向移动
D. 温度降低时,D点的饱和溶液的组成由D沿DB线向B方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸镍是一种重要的化工中间体,是镍行业研究的热点。一种以石油化工中的废镍催化剂(主要成分为NiCO3和SiO2,还含有少量Fe2O3、Cr2O3)为原料制备硫酸镍的工业流程如图:

已知:Ⅰ.NiS、Ni(OH)2、Cr(OH)3均难溶于水,Cr(OH)3是两性氢氧化物;
Ⅱ.Fe(OH)3不溶于NH4Cl-氨水的混合液,Ni(OH)2溶于NH4Cl-氨水的混合液生成[Ni(NH3)6]2+。
请回答下列问题:
(1)“酸溶”时应先将废镍催化剂粉碎,再与20%硫酸在100℃下反应2h,该操作的目的为____。
(2)“滤渣Ⅰ”的主要成分为___(填化学式),该物质在工业上的用途为___(任写一种)。
(3)“一次碱析”时,加入的NaOH溶液需过量,含铬微粒发生反应的离子方程式为__。
(4)“氨解”的目的为___。“净化”时通入H2S的目的是___。
(5)“氧化”时发生反应的离子方程式为___。
(6)“系列操作”具体是指____、过滤、洗涤、干燥。若所得NiSO4·7H2O晶体不纯,应继续进行的提纯操作名称为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com