
【题目】下列关于反应热和热化学反应的描述中正确的是
A. HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则CH3COOH和NaOH反应的中和热ΔH=-57.3 kJ·mol-1
B. CO(g)的燃烧热是283.0 kJ·mol-1,则反应2CO(g)+O2(g)===2CO2(g)的ΔH=+2×283.0 kJ·mol-1
C. 氢气的燃烧热为285.5 kJ·mol-1,则电解水的热化学方程式为2H2O(l)![]() 2H2(g)+O2(g) ΔH=+2×285.5 kJ·mol-1
2H2(g)+O2(g) ΔH=+2×285.5 kJ·mol-1
D. 1 mol甲烷燃烧生成气态水和二氧化碳时所放出的热量是甲烷的燃烧热
【答案】C
【解析】
A、CH3COOH和NaOH反应,由于醋酸存在电离平衡,放出的热量减少,ΔH反而增大,则CH3COOH和NaOH反应的中和热ΔH>-57.3 kJ·mol-1,故A错误;
B、因CO(g)的燃烧热是283.0 kJ·mol-1,则反应2CO(g)+O2(g)===2CO2(g)的ΔH=-2×283.0 kJ·mol-1,故B错误;
C、氢气燃烧热是放热反应,焓变为负值,水电解过程是吸热反应,2mol水电解反应吸收热量为571.0kJ,故C正确;
D、1 mol可燃物燃烧生成稳定氧化物放出的热量是燃烧热,而1 mol甲烷燃烧生成气态水不是稳定氧化物,应为液态水和二氧化碳所放出的热量是甲烷的燃烧热,故D错误。
答案选C。


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
【题目】某中性有机物A的分子量为88,碳的质量分数为54.5%,氢的质量分数为9.1%,其余为氧。可发生如图所示变化:
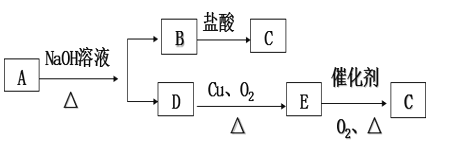
(1)C中官能团的名称是__________ 。
(2)D→E的反应类型是____________。
(3)有机物A与氢氧化钠溶液反应的化学方程式为___________。
(4)已知某烃X的相对分子质量比A小16,分子中碳与氢的质量之比为5:1。下列说法正确的是________。
A.相同条件下X的密度比水小
B. 烃X能与氢气发生还原反应
C.甲烷与烃X互为同系物
D.C、D、E可用新制氢氧化铜检验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我们可以从海水中可制取许多化工原料。以下是某化工厂对海水加工的示意图:
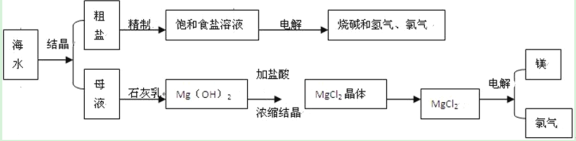
根据以上工艺流程回答下列问题:
(1)饱和食盐水被电解的化学方程式______。
(2)海水结晶过滤的母液中含有 K+ 、 Na+ 、 Mg2+等阳离子,从图中可看出对母液进行一系列的加工可制得金属镁。
①充分考虑当地海洋化学资源,从提高生产与经济效益的角度考虑,生产生石灰的主要原料是_______。
②熔融氯化镁电解制镁的化学方程式是______。
③生产过程所得的镁蒸气在特定的环境里冷却后可得固态的金属镁,下列物质中可以用作镁蒸气的冷却剂的是(填写代号)_______。
A.空气 B.Ar C.H2 D.CO2
(3)在该化工厂中,海水提取氯化钠后的母液经过提取氯化镁后又形成了新的母液,向新母液中加入氯气,又制取了重要的化工原料溴单质
①生成溴单质的化学反应的化学方程式是______,从溴苯混合物中分离出溴单质来应采用______(填实验方法)。
②获取生产单质溴的原料氯气,以下设想合理的是______(填写代号).
A 本厂生产镁单质处循环 B 从本厂生产烧碱处循环
C 在当地新建生产厂 D 从外地购买
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次氯酸锂稳定性远髙于次氯酸钠,也可用于杀菌消毒。制备次氯酸锂方法较多,常用的一种合成路线如图:
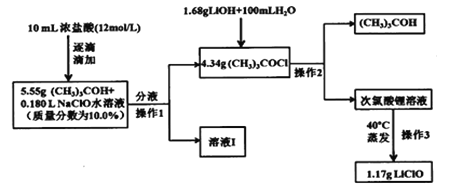
已知:1.次氯酸叔丁酯((CH3)3COCl),相对分子质量为108.5,是具有挥发性的黄色油状液体,密度为0.802g/mL,且有强烈刺激性臭味;
2.(CH3)3COCl+LiOH=LiClO+(CH3)3COH
请回答:
(1)实验第一步的反应装置如图所示(夹持装置省略),①B装置中支管的作用是________;②浓盐酸逐滴滴加而不是一次性加入的原因是__________。
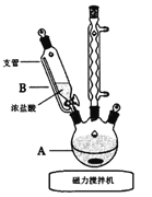
(2)请写出在装置A中发生反应的化学方程式______________。
(3)进行操作3时,并不是直接加热蒸发溶液,而是选择在40°C下缓慢蒸发溶液,试解释其原因___________。
(4)该实验中次氯酸锂的产率为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 银锌纽扣电池的放电反应:Zn+Ag2O+H2O=Zn(OH)2+2Ag,其中Ag2O作正极,发生还原反应
B. 通过构成原电池,能将反应的化学能全部转化为电能
C. 如图原电池中,电池工作时,SO42-移向电池的正极
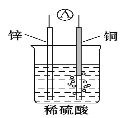
D. 构成原电池的两个电极必须是活泼性不同的两种金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某l00mL溶液可能含有Na+、NH4+、Fe3+、CO32 -、SO42 -、Cl-中的若干种,取该溶液进行连续实验,实验过程如图:(所加试剂均过量,气体全部逸出)下列说法不正确的是( )

A. 原溶液一定存在CO32 -和SO42 -,一定不存在Fe3+
B. 是否存在Na+只有通过焰色反应才能确定
C. 原溶液一定存在Na+,可能存在Cl-
D. 若原溶液中不存在Cl-,则c (Na+) =0.1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
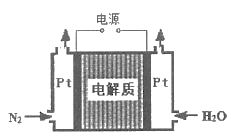
【题目】氮是一种重要的元素,其对应化合物在生产生活中有重要的应用。
(1)氮化铝(AlN)可用于制备耐高温的结构陶瓷,遇强碱会腐蚀,写出AlN与氢氧化钠溶液反应的离子方程式_____。
(2)氨是制备氮肥、硝酸等的重要原料
①已知:N2(g)+3H2(g) ![]() 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
N2(g)+O2(g) ![]() 2NO(g) △H=+180 kJ/mol
2NO(g) △H=+180 kJ/mol
2H2(g)+O2(g) ![]() 2H2O(1) △H= -571.6 kJ/mol
2H2O(1) △H= -571.6 kJ/mol
试写出表示氨的标准燃烧热的热化学方程式_____。
②某电解法制氨的装置如图所示,电解质只允许质子通过,试写出阴极的电极反应式_____。
(3)反应:2NO(g)+O2(g) ![]() 2NO2(g)△H<0 是制备硝酸过程中的一个反应。
2NO2(g)△H<0 是制备硝酸过程中的一个反应。
①将NO和O2按物质的量之比为 2:1 置于恒温恒容密闭容器中进行上述反 应,得到NO2 体积分数与时间的关系如图所示。保持其它条件不变,t1 时再向 容器中充入适量物质的量之比为2:1的NO和O2的混合气体,t2 时再次达到平 衡,请画出 tl-t3 时间范围内 NO2 体积分数随时间的变化曲线:_________。

②在研究此反应速率与温度的关系时发现,NO 转化成 NO2 的速率随温度升高反而减慢。进一步研究发现,上述反应实际是分两步进行的:
I.2NO(g) ![]() N2O2(g) △H<0
N2O2(g) △H<0
II.N2O2(g)+O2(g) ![]() 2NO2(g) △H<0
2NO2(g) △H<0
已知反应I能快速进行,试结合影响化学反应速率的因素和平衡移动理论分析,随温度升高,NO 转化成 NO2 的速率减慢的可能原因________。
(4)已知常温下,Ka(CH3COOH)=Kb(NH3·H2O)=l.8×l0-5。则常温下 0.lmol/L 的 CH3COONH4 溶液中,c(CH3COO-):c(NH3·H2O)=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
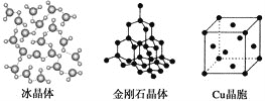
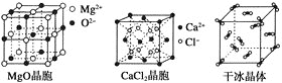
【题目】下列各图为几种晶体或晶胞的构型示意图。
请回答下列问题:
(1)这些晶体中,粒子之间以共价键结合形成的晶体是_______________________。
(2)冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为_________。
(3)NaCl晶胞与MgO晶胞相同,NaCl晶体的晶格能________(填“大于”或“小于”)MgO晶体的晶格能,原因是___________________________________________。
(4)每个Cu晶胞中实际占有________个Cu原子,CaCl2晶体中Ca2+的配位数为________。
(5)冰的熔点远高于干冰的重要原因是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,可用离子方程式![]() +2H+=CO2↑+H2O表示的是( )
+2H+=CO2↑+H2O表示的是( )
A.碳酸钙和足量盐酸的反应B.碳酸钠溶液与氯化钙溶液的反应
C.碳酸钠溶液与足量稀硝酸反应D.碳酸钡和足量硫酸的反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com