
【题目】下列说法正确的是
A. 银锌纽扣电池的放电反应:Zn+Ag2O+H2O=Zn(OH)2+2Ag,其中Ag2O作正极,发生还原反应
B. 通过构成原电池,能将反应的化学能全部转化为电能
C. 如图原电池中,电池工作时,SO42-移向电池的正极
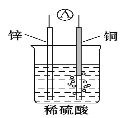
D. 构成原电池的两个电极必须是活泼性不同的两种金属
科目:高中化学 来源: 题型:
【题目】利用以下装置完成下列实验(图中a、b、c、d 为止水夹)。
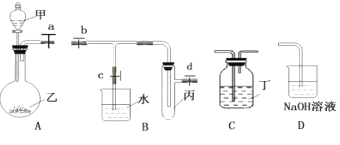
(1)仪器乙的名称_________。
(2)装置 A、B、D 相连,可证明SO2在水中的溶解度,相关操作依次是:制取 SO2,收集 SO2, 关闭止水夹 b、d,打开止水夹 c,_____________,
(3)若烧杯中有大量水倒吸入丙试管中,说明 SO2 易溶于水。 装置 A、C 相连,可用于证明C、Si 的非金属性强弱,则试剂甲是_____________,C 中 的 现 象 是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究元素周期律。甲同学设计了如图1装置,根据元素非金属性与对应最高价含氧酸之间的关系,可以一次性完成碳族元素中C与Si的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律。A、B、C三处分别是蘸有NaBr溶液的棉花、湿润的淀粉KI试纸、蘸有碱液的棉花。已知常温下浓盐酸与高锰酸钾能反应生成氯气。
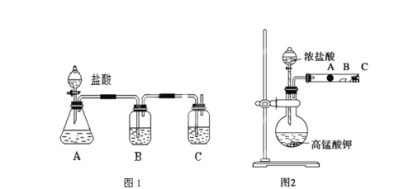
(1)根据实验图1作答:
①写出选用试剂分别 B__________,C____________
②装置B中所盛试剂的作用为_________
③C中反应的离子方程式为_______
④从实验所得非金属性C____Si(填“大于”或“小于”)
(2)根据实验图2作答:
①写出 A处的离子方程式:_______
②B处的现象_____
③C处药品的作用 _______。
④通过图2 装置实验得出同主族元素性质的递变规律为___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、W 为五种短周期元素,X、Y、Z 是原子序数依次递增的同周期元素,且最外层电子数之和为 15;X 与 Z 可形成 XZ2 分子;Y 与 M 形成的气态化合物在标准状态下的密度为 0.76 g·L-1;W 的质子数是 X、Y、Z、M 四种元素质子数之和的 1/2。下列说法正确的是( )
A.原子半径:W>X>Y>Z>M
B.XZ2、X2M2、W2Z2 均为直线形的共价化合物
C.CaM2 和 CaZ2 两种化合物中,阳离子与阴离子个数比均为 1∶2
D.由 X、Y、Z、M 四种元素共同形成的化合物中一定有共价键,可能有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于氢氧燃料电池,下列说法正确的是( )
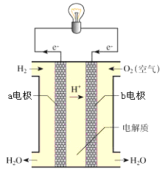
A.用 KOH 做电解质,负极反应是 H2-2e-+2OH-=2H2O
B.电子从 a 电极通过外电路到 b 电极最终移到 a 电极形成闭合回路
C.原电池不能将化学能百分之百转化成电能
D.氢氧燃料电池在使用过程中会看到淡蓝色火焰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于反应热和热化学反应的描述中正确的是
A. HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则CH3COOH和NaOH反应的中和热ΔH=-57.3 kJ·mol-1
B. CO(g)的燃烧热是283.0 kJ·mol-1,则反应2CO(g)+O2(g)===2CO2(g)的ΔH=+2×283.0 kJ·mol-1
C. 氢气的燃烧热为285.5 kJ·mol-1,则电解水的热化学方程式为2H2O(l)![]() 2H2(g)+O2(g) ΔH=+2×285.5 kJ·mol-1
2H2(g)+O2(g) ΔH=+2×285.5 kJ·mol-1
D. 1 mol甲烷燃烧生成气态水和二氧化碳时所放出的热量是甲烷的燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国化学家研究出一种新型复合光催化剂(C3N4/CQDs),能利用太阳光高效分解水,原理如下图所示。下列说法不正确的是
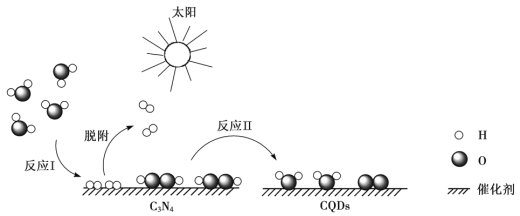
A. 通过该催化反应,实现了太阳能向化学能的转化
B. 反应I中涉及到非极性键的断裂和极性键的形成
C. 反应II为:2H2O2 ![]() 2H2O + O2↑
2H2O + O2↑
D. 总反应为:2H2O![]() 2H2↑+ O2↑
2H2↑+ O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同条件下,用O2氧化一定浓度的FeCl2溶液过程中所测的实验数据如图所示。下列分析或推测不合理的是

A. Fe2+的氧化率随时间延长而逐渐增大
B. 由②和③可知,pH越大,Fe2+氧化速率越快
C. 由①和③可知,温度越高,Fe2+氧化速率越快
D. 氧化过程的离子方程式为:4Fe2+ + O2 + 4H+ == 4Fe3+ + 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数,下列说法正确的是
A. 1L1mol/LMgCl2溶液中含有的Mg2+离子数为NA
B. 100 mL 2.0 mol/L的盐酸与醋酸溶液中氢离子均为0.2NA
C. 0.1mol/L稀硫酸中含SO42- 的数目为0.1NA
D. 标准状况下,11.2LNO和5.6LO2混合后,分子总数小于0.5NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com