
【题目】利用以下装置完成下列实验(图中a、b、c、d 为止水夹)。
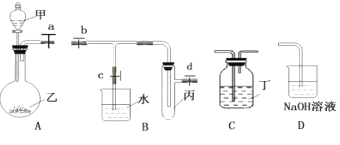
(1)仪器乙的名称_________。
(2)装置 A、B、D 相连,可证明SO2在水中的溶解度,相关操作依次是:制取 SO2,收集 SO2, 关闭止水夹 b、d,打开止水夹 c,_____________,
(3)若烧杯中有大量水倒吸入丙试管中,说明 SO2 易溶于水。 装置 A、C 相连,可用于证明C、Si 的非金属性强弱,则试剂甲是_____________,C 中 的 现 象 是____________。
【答案】圆底烧瓶 用手捂热试管 H2SO4溶液(或稀硫酸) 出现白色沉淀
【解析】
(1)图中仪器乙为圆底烧瓶;
(2)装置 A是用来制取SO2、装置B用来验证SO2溶解性、装置D用来尾气回收,操作依次是:制取 SO2,收集 SO2, 关闭止水夹 b、d,打开止水夹 c,用手捂热试管,若烧杯中有大量水倒吸入丙试管中,说明 SO2 易溶于水;
(3)装置 A、C 相连,可用于证明C、Si 的非金属性强弱,则在A中发生反应制取CO2,试剂甲是比碳酸酸性强的酸H2SO4,在C中盛放Na2SiO3溶液,若出现白色H2SiO3沉淀,则证明C的非金属性比Si强。
(1)图中仪器乙为圆底烧瓶;
本题答案为:圆底烧瓶。
(2)装置 A是用来制取SO2、装置B用来验证SO2溶解性、装置D用来尾气回收,操作依次是:制取 SO2,收集 SO2, 关闭止水夹 b、d,打开止水夹 c,用手捂热试管,若烧杯中有大量水倒吸入丙试管中,说明 SO2 易溶于水;
本题答案为:用手捂热试管。
(3)装置 A、C 相连,可用于证明C、Si 的非金属性强弱,则在A中发生反应制取CO2,试剂甲是比碳酸酸性强的酸H2SO4,在C中盛放Na2SiO3溶液,若出现白色H2SiO3沉淀,则证明C的非金属性比Si强;
本题答案为:H2SO4溶液(或稀硫酸)、出现白色沉淀。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】W、X、Y、Z均为短周期元素,W的最外层电子数与核外电子总数之比为7:17;X与W同主族;Y的原子序数是W和X的原子序数之和的一半;含Z元素的物质焰色反应为黄色。下列判断正确的是( )
A.气态氢化物的稳定性:X﹥W
B.金属性:Y﹥Z
C.最高价含氧酸的酸性:X﹥W
D.原子半径:Y﹥Z﹥X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)难溶物PbSO4溶于CH3COONH4溶液可制得易溶于水的(CH3COO)2Pb,发生的反应为PbSO4+2CH3COONH4=(CH3COO)2Pb+(NH4)2SO4,说明(CH3COO)2Pb是________(填“强”或“弱”)电解质。
(2)已知次磷酸(H3PO2)与足量的氢氧化钠溶液反应生成NaH2PO2和H2O,则次磷酸是_____元酸(填“一”、“二”或“三”)。
(3)工业上制玻璃和水泥需用到的共同原料是________(填化学式)。
(4)在一定温度下,向一个2 L的真空密闭容器中(预先装入催化剂)通入1 mol N2和3 mol H2,发生反应:N2(g)+3H2(g)2NH3(g)。经过一段时间后,测得容器内压强是起始的0.9倍,在此时间内,H2平均反应速率为0.1 mol/(L·min),则所经过的时间为______min
(5)高铁酸钠(Na2FeO4)具有强氧化性,可对自来水进行消毒、净化。高铁酸钠可用氢氧化铁和次氯酸钠在碱性介质中反应得到,请补充并配平下面离子方程式。
____Fe(OH)3 +____ClO-+____OH-=__FeO42-+___Cl-+__
(6)在反应11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中,氧化剂是___________;当有2mol H3PO4生成,转移的电子的物质的量为___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用该浓硫酸配制100 mL 1 mol/L的稀硫酸。可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平。请回答下列问题:
(1)配制稀硫酸时,上述仪器中不需要使用的有__________(填序号),还缺少的仪器有____________________(写仪器名称);
(2)经计算,配制100mL1mol/L的稀硫酸需要用量筒量取上述浓硫酸的体积为____________________________________________mL(保留一位小数),量取浓硫酸时应选用_________(选填10mL、50mL 、100mL)规格的量筒;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某中性有机物A的分子量为88,碳的质量分数为54.5%,氢的质量分数为9.1%,其余为氧。可发生如图所示变化:
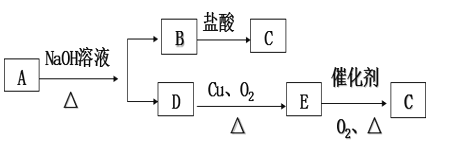
(1)C中官能团的名称是__________ 。
(2)D→E的反应类型是____________。
(3)有机物A与氢氧化钠溶液反应的化学方程式为___________。
(4)已知某烃X的相对分子质量比A小16,分子中碳与氢的质量之比为5:1。下列说法正确的是________。
A.相同条件下X的密度比水小
B. 烃X能与氢气发生还原反应
C.甲烷与烃X互为同系物
D.C、D、E可用新制氢氧化铜检验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化钾溶液常用作利尿剂及防治缺钾症的药物,某医疗实验小组需要用到480 mL物质的量浓度为0.5 mol·L-1的氯化钾溶液。回答下列问题:
(1)配制该溶液,需称量氯化钾晶体的质量是________。
(2)配制上述氯化钾溶液,需要使用的玻璃仪器是量筒、烧杯、玻璃棒、________、________。
(3)如图Ⅰ表示10 mL量筒中液面的位置,刻度A与B,B与C间均相差1 mL,如果刻度A为9,则量筒中液体的体积是________mL。

(4)定容时,某同学操作示意图如图Ⅱ所示,则其所配氯化钾溶液的浓度________(填“大于”“等于”或“小于”)0.5 mol·L-1;某同学由于操作不慎,定容时导致液面高于刻度线,他立即用胶头滴管将液体吸出,使液面恰好达到刻度线,请你评价该同学的做法:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各步制取物质,最终无法达到目的的有
A. Al![]() Al2O3
Al2O3![]() Al(NO3)3
Al(NO3)3![]() Al(NO3)3晶体
Al(NO3)3晶体
B. Cu![]() CuO
CuO![]() CuSO4溶液
CuSO4溶液![]() CuSO4·5H2O
CuSO4·5H2O
C. Fe![]() FeCl3
FeCl3![]() Fe(OH)3
Fe(OH)3![]() Fe2O3
Fe2O3
D. CuSO4溶液![]() CuS
CuS![]() CuS
CuS
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 银锌纽扣电池的放电反应:Zn+Ag2O+H2O=Zn(OH)2+2Ag,其中Ag2O作正极,发生还原反应
B. 通过构成原电池,能将反应的化学能全部转化为电能
C. 如图原电池中,电池工作时,SO42-移向电池的正极
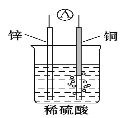
D. 构成原电池的两个电极必须是活泼性不同的两种金属
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com