
【题目】元素R、T、X、Y、Z在元素周期表中的相对位置如图所示,其中Z单质与H2混合遇强光会发生爆炸。则下列判断错误的是

A.气态氢化物的沸点:H2T>H2Y>H2R
B.R与Y的电子数相差8
C.非金属性:Z>Y>X
D.Z的含氧酸的酸性比Y的强
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、W 为五种短周期元素,X、Y、Z 是原子序数依次递增的同周期元素,且最外层电子数之和为 15;X 与 Z 可形成 XZ2 分子;Y 与 M 形成的气态化合物在标准状态下的密度为 0.76 g·L-1;W 的质子数是 X、Y、Z、M 四种元素质子数之和的 1/2。下列说法正确的是( )
A.原子半径:W>X>Y>Z>M
B.XZ2、X2M2、W2Z2 均为直线形的共价化合物
C.CaM2 和 CaZ2 两种化合物中,阳离子与阴离子个数比均为 1∶2
D.由 X、Y、Z、M 四种元素共同形成的化合物中一定有共价键,可能有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同条件下,用O2氧化一定浓度的FeCl2溶液过程中所测的实验数据如图所示。下列分析或推测不合理的是

A. Fe2+的氧化率随时间延长而逐渐增大
B. 由②和③可知,pH越大,Fe2+氧化速率越快
C. 由①和③可知,温度越高,Fe2+氧化速率越快
D. 氧化过程的离子方程式为:4Fe2+ + O2 + 4H+ == 4Fe3+ + 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PbCO3广泛用于陶瓷、油漆和颜料配制等。一种由方铅矿(主要成分为PbS,含少量FeS)和软锰矿(主要成分为MnO2)为原料制备PbCO3的流程如图:
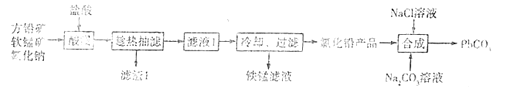
已知:①“酸浸”时PbS反应的方程式为PbS+MnO2+4Cl-+4H+=== PbCl42-+Mn2++S+2H2O。PbCl2易溶于热水,难溶于冷水。在盐酸中因与Cl-形成配合离子PbCl42-而增大PbCl2的溶解度.
②常温下,几种金属离子沉淀的pH如表:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
开始沉淀的pH | 1.5 | 7.5 | 8.8 |
完全沉淀的pH | 2.3 | 9.7 | 10.4 |
(1)“酸浸”之前需要将方铅矿、软锰矿和氧化钠粉碎并混合均匀,其目的是____。
(2)“趁热抽滤”的目的是___。
(3)铁锰滤液中阳离子主要是Mn2+,还含少量Fe3+、Fe2+。从铁锰滤液中得到较纯锰盐溶液有两种方案:
方案甲:向滤液中加入酸化的双氧水,再加入足量MnCO3粉末,过滤得到锰盐溶液。
方案乙:向滤液中加入稀硫酸酸化,然后加入二氧化锰粉末,充分反应;最后,加氨水调节溶液pH,过滤。
①方案甲中加入MnCO3的目的是_____。
②用离子方程式表示方案乙中“加入二氧化锰”的作用:____。
已知常温下,Ksp[Fe(OH)3]≈1.0×10-38,为了使溶液中c(Fe3+)=1.0×10-5mol·L-1,此时溶液的pH= ____。
③从操作、产品纯度角度考虑,方案____(填“甲”或”乙”)优于另一种方案。
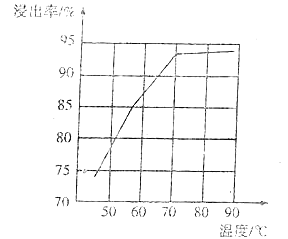
(4)研究工业生产中温度对浸出率的影响如图所示,则生产中浸出过程的最佳温度是___。
(5)向氯化铅(难溶于水)产品中加入氯化钠溶液和碳酸钠溶液,得到碳酸铅产品后,要经过“过滤、洗涤、干燥”等操作,检验碳酸铅是否洗涤干净的操作是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋是一个巨大的资源宝库。在海洋中生长的海带,富含碘元素。某同学设计以下实验方案,从海带中提取I2。
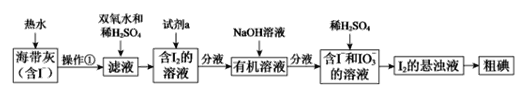
(1)灼烧海带时,除需酒精灯与三脚架外,还需要用到的实验仪器是___。
(2)向滤液中加入双氧水和稀硫酸发生反应的离子方程式是__________。
(3)试剂a可以是_________(填序号)。
A 酒精 B 四氯化碳
C 裂化汽油 D 苯
(4)I-和IO3-在酸性条件下生成I2的离子方程式是__________。
(5)上图中,含I2的溶液经3步转化为I2的悬浊液,其目的是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2和 I2在一定条件下能发生反应:H2(g)+I2(g)![]() 2HI(g),1 mol H2 完全反应放出 akJ热量。已知:(a、b、c 均大于零)。下列说法不正确的是
2HI(g),1 mol H2 完全反应放出 akJ热量。已知:(a、b、c 均大于零)。下列说法不正确的是
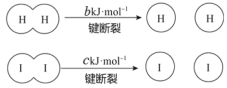
A.反应物的总能量高于生成物的总能量
B.断开 1 mol H—H 键和 1 mol I—I 键所需能量大于断开 2 mol H—I 键所需能量
C.断开 2 mol H—I 键所需能量约为(c+b+a)kJ
D.向密闭容器中加入 2 mol H2 和 2 mo l I2,充分反应放出的热量小于 2a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数,下列说法正确的是
A. 1L1mol/LMgCl2溶液中含有的Mg2+离子数为NA
B. 100 mL 2.0 mol/L的盐酸与醋酸溶液中氢离子均为0.2NA
C. 0.1mol/L稀硫酸中含SO42- 的数目为0.1NA
D. 标准状况下,11.2LNO和5.6LO2混合后,分子总数小于0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置可以将温室气体CO2转化为燃料气体CO。下列说法正确的是
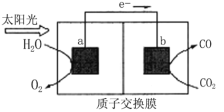
A.该装置工作时,H+从b极区向a极区移动
B.电极a表面发生还原反应
C.该过程至少涉及到3种能量的转化
D.该装置中每生成1molCO,同时生成1molO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值。下列说法不正确的是( )
A.H2SO4的摩尔质量以g·mol-1为单位时,与NA个硫酸分子的质量以g为单位时在数值上相等
B.NA个氧气分子和NA个氮气分子的质量比为8∶7
C.常温常压下,2.86gNa2CO3·10H2O含有的Na+个数为0.02NA
D.物质的量浓度为0.5mol/L的CaCl2溶液中,含有的Cl-个数为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com