
【题目】海洋是一个巨大的资源宝库。在海洋中生长的海带,富含碘元素。某同学设计以下实验方案,从海带中提取I2。
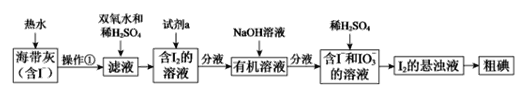
(1)灼烧海带时,除需酒精灯与三脚架外,还需要用到的实验仪器是___。
(2)向滤液中加入双氧水和稀硫酸发生反应的离子方程式是__________。
(3)试剂a可以是_________(填序号)。
A 酒精 B 四氯化碳
C 裂化汽油 D 苯
(4)I-和IO3-在酸性条件下生成I2的离子方程式是__________。
(5)上图中,含I2的溶液经3步转化为I2的悬浊液,其目的是_________。
【答案】坩埚、泥三角 2I-+ H2O2 + 2H+ = I2 + 2H2O BD 5I-+IO3-+6H+ = 3I2 + 3H2O 富集碘元素
【解析】
(1)灼烧需要坩埚、泥三角、三角架、酒精灯、坩埚钳;
(2)滤液中含有碘离子加入双氧水和稀硫酸反应生成碘单质和水;
(3)试剂a是从I2的水溶液中分离得到I2,操作为萃取,萃取剂选择时应选择与原试剂互不相溶,且I2在萃取剂中的溶解度比在水中大,以此分析;
(4)I-和IO3-在酸性条件下生成I2和水,根据电子守恒、电荷守恒及原子守恒配平方程;
(5)上图中,含I2的溶液经3步转化为I2的悬浊液,其目的是提高I2的浓度,达到富集碘元素的目的。
(1)灼烧需要坩埚、泥三角、三角架、酒精灯、坩埚钳,则步骤①灼烧海带时,除需要酒精灯与三脚架外,还需要用到的实验仪器是坩埚、泥三角;故答案为坩埚、泥三角;
(2)向滤液中加入双氧水和稀硫酸发生反应的离子方程式是2I-+ H2O2 + 2H+ = I2 + 2H2O,故答案为:2I-+ H2O2 + 2H+ = I2 + 2H2O;
(3)试剂a是从I2的水溶液中分离得到I2可以根据I2容易溶于有机溶剂苯、四氯化碳中溶解度大而在水中溶解度较小,苯或四氯化碳与水互不相溶,且与I2不反应的性质,通过萃取分离得到,因此可以是四氯化碳、苯,而不能使用与水互溶的或容易溶于水的乙醇、乙酸;故答案为:BD。
(4) I-和IO3-在酸性条件下生成I2和水,根据电子守恒、电荷守恒及原子守恒,可得反应的离子方程式是5I-+IO3-+6H+ = 3I2 + 3H2O。故答案为:5I-+IO3-+6H+ = 3I2 + 3H2O。
(5) 上图中,含I2的溶液经3步转化为I2的悬浊液,其目的是提高I2的浓度,达到富集碘元素的目的。故答案为:富集碘元素


科目:高中化学 来源: 题型:
【题目】一定温度下,在 2 L 密闭容器中,A、B、C 三种气体的物质的量随时间变化的曲线如图所示。下列说法正确的是( )
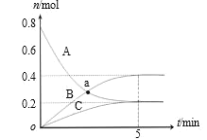
A.反应开始到 5min,υ(C)=0.2 mol/(L·min)
B.反应开始到 5min,B 的物质的量浓度增加了 0.4 mol/L
C.反应的化学方程式为:2B(g)+C(g)![]() 3A(g)
3A(g)
D.a 点时,c(A)=c(B)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的资源,下图为海水资源利用的部分过程。
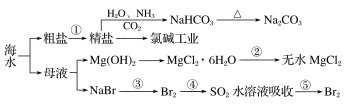
下列有关说法正确的是
A.工业上通过电解饱和MgCl2溶液制取金属镁
B.含氮、磷的大量废水排入海洋,易引发赤潮
C.反应④的离子方程式为:Br2+SO2+2H2O=2HBr+2H++ SO42-
D.在第①步中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入药品的顺序为Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如下图所示。下列说法正确的是
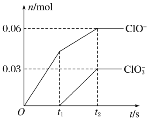
A. 苛性钾溶液中KOH的物质的量是0.09 mol
B. ClO3-的生成是由氯气的量的多少引起的
C. 在酸性条件下ClO-和ClO3-可生成Cl2
D. 反应中转移电子的物质的量是0.21 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,下列溶液的离子浓度关系式正确的是
A. pH=5的H2S溶液中,c(H+)= c(HS-)=1×10—5mol·L—1
B. pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C. pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+ c(H+)= c(OH-)+c( HC2O4-)
D. pH相同的①CH3COO Na②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素R、T、X、Y、Z在元素周期表中的相对位置如图所示,其中Z单质与H2混合遇强光会发生爆炸。则下列判断错误的是

A.气态氢化物的沸点:H2T>H2Y>H2R
B.R与Y的电子数相差8
C.非金属性:Z>Y>X
D.Z的含氧酸的酸性比Y的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭系统中有反应C(s)+CO2(g) ![]() 2CO(g),能使反应速率加快的措施是
2CO(g),能使反应速率加快的措施是
①通过减小容器体积增大压强 ②升高温度 ③将炭粉碎 ④通入CO2 ⑤增加炭的量 ⑥恒容条件下通入N2使得压强增大
A. ①②③⑥B. ①②④⑥C. ①②③④D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、D、E、G、M、L六种前四周期的元素。A是宇宙中最丰富的元素。D原子核外有1个未成对电子,D+比E原子少1个电子层,E原子得1个电子填入3p轨道后,3p轨道呈全充满状态。G原子的2p轨道有2个未成对电子,M的最高化合价和最低化合价的代数和为4,与G原子序数相差8。L位于周期表第12纵行且是六种元素中原子序数最大的。R是由M、L形成的化合物,其晶胞结构如下图所示。
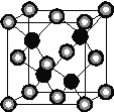
请回答下列问题:
(1)E元素的电负性________(填“>”“<”或“=”)M元素的电负性。
(2)G的第一电离能比它同周期前一族相邻元素的第一电离能________(填“大”或“小”)。
(3)M2E2广泛用于橡胶工业,在该化合物分子中,所有原子最外层均满足8电子稳定结构。则在M2E2分子中M原子的杂化类型是___,M2E2是____(填“极性”或“非极性”)分子。
(4)L的价电子排布式为________,该元素位于周期表中的________族。
(5)R的化学式为____________(用元素符号表示),属于________晶体。已知R晶体的密度为ρg·cm-3,则该晶胞的边长a________cm。(阿伏伽德常数用NA表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应Fe+H2SO4![]() FeSO4+H2↑的能量变化趋势如图所示:
FeSO4+H2↑的能量变化趋势如图所示:
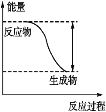
(1)该反应为____(填“吸热”或“放热”)反应。
(2)若要使该反应的反应速率增大,下列措施可行的是____(填字母)。
A.改铁片为铁粉 B.改稀硫酸为98%的浓硫酸
C.升高温度 D.减小压强
(3)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为____(填“正”或“负”)极。铜片上产生的现象为_________,该极上发生的电极反应为_______________,外电路中电子由____(填“正”或“负”,下同)极向____极移动。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com