
【题目】用价电子对互斥理论(VSEPR)可以预测许多分子或离子的空间构型,也可推测键角大小,下列判断正确的是![]()
![]()
A. CS2是V形分子 B. SnBr2键角大于![]()
C. BF3是三角锥形分子 D. NH4+键角等于10928ˊ
【答案】D
【解析】先确定中心原子上的孤电子对数和σ键电子对数,由此导出VSEPR模型,略去中心原子上的孤电子对导出分子或离子的空间构型;价电子对间的排斥作用:孤电子对间的排斥作用![]() 孤电子对与成键电子对间的排斥作用
孤电子对与成键电子对间的排斥作用![]() 成键电子对间的排斥作用,据此确定键角。
成键电子对间的排斥作用,据此确定键角。
A项,CS2中中心原子C上的孤电子对数为![]() (4-2
(4-2![]() 2)=0,σ键电子对数为2,价层电子对数为0+2=2,VSEPR模型为直线形,C上没有孤电子对,CS2是直线形分子,A项错误;B项,SnBr2中中心原子Sn上的孤电子对数为
2)=0,σ键电子对数为2,价层电子对数为0+2=2,VSEPR模型为直线形,C上没有孤电子对,CS2是直线形分子,A项错误;B项,SnBr2中中心原子Sn上的孤电子对数为![]() (4-2
(4-2![]() 1)=1,σ键电子对数为2,价层电子对数为1+2=3,VSEPR模型为平面三角形,由于孤电子对与成键电子对间的排斥作用
1)=1,σ键电子对数为2,价层电子对数为1+2=3,VSEPR模型为平面三角形,由于孤电子对与成键电子对间的排斥作用![]() 成键电子对间的排斥作用,SnBr2的键角小于120,B项错误;C项,BF3中中心原子B上的孤电子对数为
成键电子对间的排斥作用,SnBr2的键角小于120,B项错误;C项,BF3中中心原子B上的孤电子对数为![]() (3-3
(3-3![]() 1)=0,σ键电子对数为3,价层电子对数为0+3=3,VSEPR模型为平面三角形,B上没有孤电子对,BF3是平面三角形分子,C项错误;D项,NH4+中中心原子N上的孤电子对数为
1)=0,σ键电子对数为3,价层电子对数为0+3=3,VSEPR模型为平面三角形,B上没有孤电子对,BF3是平面三角形分子,C项错误;D项,NH4+中中心原子N上的孤电子对数为![]() (5-1-4
(5-1-4![]() 1)=0,σ键电子对数为4,价层电子对数为0+4=4,VSEPR模型为正四面体形,N上没有孤电子对,NH4+为正四面体形,键角等于10928ˊ,D项正确;答案选D。
1)=0,σ键电子对数为4,价层电子对数为0+4=4,VSEPR模型为正四面体形,N上没有孤电子对,NH4+为正四面体形,键角等于10928ˊ,D项正确;答案选D。


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案科目:高中化学 来源: 题型:
【题目】下列关于物质组成的说法中,正确的是
A.酸、碱、盐可能都不含金属元素
B.含氧元素的化合物一定是氧化物
C.单质不一定只含一种元素
D.酸、碱中一定含氢,盐一定不含氢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一支硬质大试管,通过排饱和食盐水的方法先后收集半试管甲烷和半试管氯气(如图),下列对于试管内发生的反应及现象的说法正确的是:

A. 为加快化学反应速率,应在强光照射下完成
B. 甲烷和 Cl2 反应后试管内壁的油状液滴物包括 CH3Cl 、CH2Cl2、CHCl3、CCl4
C. 盛放饱和食盐水的水槽底部会有少量晶体析出
D. CH4 和 Cl2 完全反应后液面上升,液体充满试管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有 A、B、C、D、E 五种短周期主族元素,原子序数由 A 到 E 逐渐增大.①A 元素最外层电子数是次外层电子数的 2 倍. ②B 的阴离子和 C 的阳离子与氖原子的电子层结构相同.③在通常状况下,B 的单质是气体,0.1molB 的气体与足量的氢气完全反应共有 0.4mol 电子转移.④C 的单质在点燃时与 B 的单质充分反应,生成淡黄色的固体, 此淡黄色固体能与 AB2 反应可生成 B 的单质.⑤D 的气态氢化物与其最高价含氧酸间能发生氧化还原反应.请写出:
(1)A 元素的最高价氧化物的电子式_________________,A 元素简单气态氢化物可构成碱性燃料电池,该电池的的负极电极方程式为:_____________________
(2)B 元素在周期表中的位置 _____________________
(3)B 单质与 C 单质在点燃时反应的生成物中所含化学键类型有 _________________
(4)D 元素的低价氧化物与 E 的单质的水溶液反应的化学方程式为 :____________________
(5)C 与 D 能形成 2:1 的化合物,用电子式表示该化合物的形成过程:_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科院的科研人员在Na-Fe3O4和HMCM-22 的表面将CO2转化为烷烃,其过程如下图。
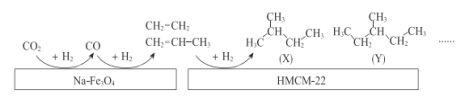
(1)Na-Fe3O4和HMCM-22 在反应中的作用为_______________
(2)(X)的系统命名的名称为_______________
(3)(Y)的一氯代物有_________________种
(4)(X)与(Y)的关系为 ________________
(5)在HMCM-22 表面生成摩尔质量为128g/mol且含两种氢的烷烃(Z),写出其结构简式___________,
(6)在HMCM-22 表面生成一种同温同压蒸气密度是氢气57倍且含有一种氢的烷烃(M),写出其与氯气反应生成一氯代烃的方程式______________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com