
肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知:
①N2(g) + 2O2(g) =2 NO2(g) ΔH = +67.7kJ/mol
②2N2H4(g) + 2NO2(g) =3N2(g) + 4H2O (g) ΔH = -1135.7kJ/mol
下列说法正确的是
A.N2H4(g) + O2(g) = N2(g) + 2H2O(g) ΔH = -1068 kJ/mol
B.肼是与氨类似的弱碱,它易溶于水,其电离方程式:N2H4 + H2O = N2H5+ + OH-
C.铂做电极,以KOH溶液为电解质溶液的肼——空气燃料电池,放电时的负极反应式:N2H4 -4e- + 4OH- = N2 + 4H2O
D.铂做电极,以KOH溶液为电解质溶液的肼——空气燃料电池,工作一段时间后,KOH溶液的pH将增大
C
【解析】
试题分析:A、根据盖斯定律,①+②得2N2H4(g)+2O2(g)=2N2(g)+4H2O(g)△H =-1068 kJ/mol,即N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534kJ/mol,错误;B、N2H4不是电解质,N2H4•H2O是弱电解质,电离方程式为N2H4•H2O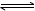 N2H5++OH-,错误;C、原电池总反应为N2H4+O2=N2+2H2O,原电池正极发生还原反应,氧气在正极放电,碱性条件下,正极电极反应式为O2+2H2O+4e-=4OH-,总反应式减去正极反应式可得负极电极反应式为N2H4-4e-+4OH-=N2+4H2O,正确;D、原电池总反应为N2H4+O2=N2+2H2O,反应生成水,随反应进行KOH溶液浓度降低,碱性减弱,溶液PH值减小,错误。
N2H5++OH-,错误;C、原电池总反应为N2H4+O2=N2+2H2O,原电池正极发生还原反应,氧气在正极放电,碱性条件下,正极电极反应式为O2+2H2O+4e-=4OH-,总反应式减去正极反应式可得负极电极反应式为N2H4-4e-+4OH-=N2+4H2O,正确;D、原电池总反应为N2H4+O2=N2+2H2O,反应生成水,随反应进行KOH溶液浓度降低,碱性减弱,溶液PH值减小,错误。
考点:考查盖斯定律、热化学方程式书写、弱电解质的电离、原电池工作原理与电极反应式书写。


科目:高中化学 来源: 题型:
(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101 kPa时,32.0 g N2H4在氧气中完全燃烧生成氮气,放出热量624 kJ(25℃时),N2H4完全燃烧反应的热化学方程式是____________________________________________________________________。
(2)肼-空气燃料电池是一种碱性燃料电池,电解质是20%—30%的KOH溶液。写出肼-空气燃料电池放电时正、负极的电极反应式。
正极:________________________________,
负极:________________________________
(3)图2-2-5是一个电化学过程示意图。
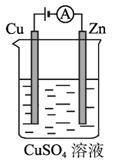
图2-2-5
①锌片上发生的电极反应是________________________________________________。
②假设使用肼?空气燃料电池作为本过程中的电源、铜片的质量变化128 g,则肼-空气燃料电池理论上消耗标标准状况下的空气___________L(假设空气中氧气体积含量为20%)
(4)传统制备肼的方法,是以NaClO氧化NH3,制得肼的稀溶液。该反应的离子方程式是________________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖南省株洲市高三第四次月考化学试卷(解析版) 题型:选择题
肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知:
①N2(g) + 2O2(g) =2 NO2(g) ΔH = +67.7kJ/mol
②2N2H4(g) + 2NO2(g) =3N2(g) + 4H2O (g) ΔH = -1135.7kJ/mol
下列说法正确的是
A.N2H4(g) + O2(g) = N2(g) + 2H2O(g) ΔH = -1068 kJ/mol
B.肼是与氨类似的弱碱,它易溶于水,其电离方程式:N2H4 + H2O = N2H5+ + OH-
C.铂做电极,以KOH溶液为电解质溶液的肼——空气燃料电池,放电时的负极反应式:N2H4 -4e- + 4OH- = N2 + 4H2O
D.铂做电极,以KOH溶液为电解质溶液的肼——空气燃料电池,工作一段时间后,KOH溶液的pH将增大
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖南省株洲市高三第四次月考化学试卷(解析版) 题型:选择题
肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知:
①N2(g) + 2O2(g) =2 NO2(g) ΔH = +67.7kJ/mol
②2N2H4(g) + 2NO2(g) =3N2(g) + 4H2O (g) ΔH = -1135.7kJ/mol
下列说法正确的是
A.N2H4(g) + O2(g) = N2(g) + 2H2O(g) ΔH = -1068 kJ/mol
B.肼是与氨类似的弱碱,它易溶于水,其电离方程式:N2H4 + H2O = N2H5+ + OH-
C.铂做电极,以KOH溶液为电解质溶液的肼——空气燃料电池,放电时的负极反应式:N2H4 -4e- + 4OH- = N2 + 4H2O
D.铂做电极,以KOH溶液为电解质溶液的肼——空气燃料电池,工作一段时间后,KOH溶液的pH将增大
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖南省株洲市高三第四次月考化学试卷(解析版) 题型:选择题
肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知:
①N2(g) + 2O2(g) =2 NO2(g) ΔH = +67.7kJ/mol
②2N2H4(g) + 2NO2(g) =3N2(g) + 4H2O (g) ΔH = -1135.7kJ/mol
下列说法正确的是
A.N2H4(g) + O2(g) = N2(g) + 2H2O(g) ΔH = -1068 kJ/mol
B.肼是与氨类似的弱碱,它易溶于水,其电离方程式:N2H4 + H2O = N2H5+ + OH-
C.铂做电极,以KOH溶液为电解质溶液的肼——空气燃料电池,放电时的负极反应式:N2H4 -4e- + 4OH- = N2 + 4H2O
D.铂做电极,以KOH溶液为电解质溶液的肼——空气燃料电池,工作一段时间后,KOH溶液的pH将增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com