
【题目】(1)在有机化学中广泛采用系统命名法,根据系统命名法原则,回答下列问题:
①系统命名法命名下列物质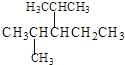 ___;
___;
②3,4-二甲基-2-戊烯的结构简式是___;
(2)![]() 中含有的官能团的名称为__。
中含有的官能团的名称为__。
(3)按要求书写下列化学方程式:
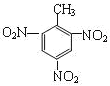
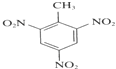
①甲苯制备TNT___;
②实验室制备乙烯___。
(4)下列物质的沸点按由高到低的顺序排列正确的是__。
①CH3(CH2)2CH3 ②CH3(CH2)3CH3 ③(CH3)3CH ④(CH3)2CHCH2CH3
A.④③②① B.②④③① C.②④①③ D.④②①③
(5)现有下列6种与人们生产生活相关的有机物:①CH3COOH(调味剂)②HCOOCH3(烟草熏蒸剂)③![]() (制酚醛树脂)④
(制酚醛树脂)④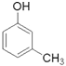 (生产杀虫剂)⑤CH2=CH-CH=CH2(合成橡胶原料)⑥HCHO(防腐剂)。其中与①互为同分异构体的是___(填序号)。
(生产杀虫剂)⑤CH2=CH-CH=CH2(合成橡胶原料)⑥HCHO(防腐剂)。其中与①互为同分异构体的是___(填序号)。
【答案】2,4-二甲基-3-乙基戊烷 CH3CH=C(CH3)CH(CH3)2 羟基、酯基 ![]() +3HO-NO2
+3HO-NO2![]()
 +3H2O CH3CH2OH
+3H2O CH3CH2OH![]() CH2=CH2↑+H2O C ②
CH2=CH2↑+H2O C ②
【解析】
(1)①烷烃命名时,选最长的碳链为主链,当有多条主链可以选择时,应选择支链多的一条,故主链上有5个碳原子,为戊烷,从离支链近的一端给主链上的碳原子进行编号,故在2号和4号碳原子上各有一个甲基,在3号碳原子上有一个乙基,故名称为2,4-二甲基-3-乙基戊烷,故答案为:2,4-二甲基-3-乙基戊烷;
②3,4-二甲基-2-戊烯的主链上有5个碳原子在2号和3号碳原子之间有碳碳双键,在3号和4号碳原子上各有一个甲基,结构简式为CH3CH=C(CH3)CH(CH3)2,故答案为:CH3CH=C(CH3)CH(CH3)2;
(2)![]() 中含官能团为羟基和酯基,故答案为:羟基、酯基;
中含官能团为羟基和酯基,故答案为:羟基、酯基;
(3)①甲苯和浓硝酸在浓硫酸做催化剂、加热的条件下发生硝化反应制取三硝基甲苯即TNT,化学方程式为![]() +3HNO3
+3HNO3 ![]()
 +3H2O,故答案为:
+3H2O,故答案为:![]() +3HNO3
+3HNO3 ![]()
 +3H2O;
+3H2O;
②实验室用乙醇和浓硫酸共热至170℃制备乙烯,化学方程式为CH3CH2OH![]() CH2=CH2↑+H2O,故答案为:CH3CH2OH
CH2=CH2↑+H2O,故答案为:CH3CH2OH![]() CH2=CH2↑+H2O;
CH2=CH2↑+H2O;
(4)给出的物质都是烷烃,烷烃随着分子中碳原子数的递增,沸点逐渐升高;碳原子数相同的烷烃,支链越多,熔、沸点越低,由②④中含有5个碳原子,①③中含有4个碳原子,故②④的沸点高于①③,而①中没有支链,③中1个支链,故沸点①>③;而②中无支链,④中有1个支链,所以②沸点最高,③沸点最低,④沸点高于①,故沸点由高到低为②④①③,故选C;
(5)分子式相同而结构不同的化合物间互为同分异构体,故和①CH3COOH互为同分异构体的是②,故答案为:②。


科目:高中化学 来源: 题型:
【题目】美国科学家合成了含有N5+的盐类,含有该离子的盐是高能爆炸物质,该离子的结构呈V 形,如图所示(图中箭头代表单键)。下列有关该物质的说法中正确的是
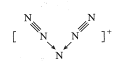
A.每个Ns+中含有35个质子和36个电子B.该离子中只含有非极性键
C.该离子中含有2个π键D.![]() 与
与![]() 互为等电子体
互为等电子体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学按如图所示实验装置探究铜与浓硫酸的反应,记录实验现象如表。下列说法正确的是
试管 | ① | ② | ③ | ④ |
实验现象 | 溶液仍为无色,有白雾、白色固体产生 | 有大量白色沉淀产生 | 有少量白色沉淀产生 | 品红溶液褪色 |
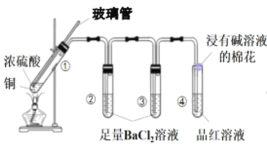
A.②中白色沉淀是BaSO3
B.①中可能有部分浓硫酸挥发了
C.为了确定①中白色固体是否为硫酸铜,可向冷却后的试管中注入水,振荡
D.实验时若先往装置内通入足量N2,再加热试管①,实验现象不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2H4·H2O(水合肼)极毒且不稳定,100℃以上易分解失水,常用作还原剂和除氧剂(通常生成N2和H2O),其熔点为-40℃,沸点118.5℃。现以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4·H2O和无水Na2SO3,其主要流程如下:
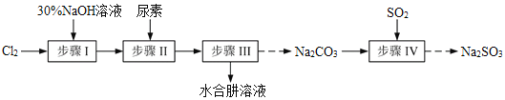
已知:Cl2(g)+2OH-(aq)=ClO-(aq)+Cl-(aq)+H2O(aq) △H<0
(1)配制30%NaOH溶液时,所需玻璃仪器除量筒、烧杯外,还需要_____________(填标号)。
A.容量瓶 B.胶头滴管 C.玻璃棒 D.锥形瓶
(2)步骤Ⅰ制备NaClO溶液时,若温度超过40℃,Cl2与NaOH溶液充分反应生成NaClO3和NaCl。实验中为控制反应温度除了用冰水浴、充分搅拌外,还需采取的措施是_______________________。
(3)步骤Ⅱ合成N2H4·H2O的装置如图1所示。NaClO碱性溶液与尿素水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应。实验中通过滴液漏斗滴加的溶液是_____________(填字母);
a.尿素溶液 b.NaClO碱性溶液 c.尿素溶液或NaClO溶液任选其一
理由是____________________________________。
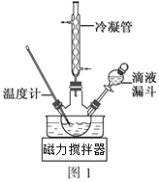
(4)步骤Ⅲ中分离出N2H4·H2O应该采用的方法最合理是____________________。
(5)步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3(水溶液中H2SO3、HSO3-、SO32-随pH的分布如图2所示,Na2SO3的溶解度曲线如图3所示)。
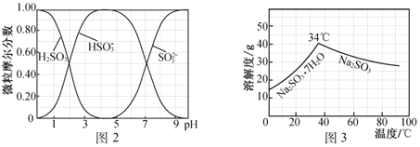
①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通SO2的方法是______________。
②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案:_________________________________,用少量无水乙醇洗涤,干燥,密封包装。
(6)工业上还可以用水合肼还原法制取碘化钠,工艺流程如图:
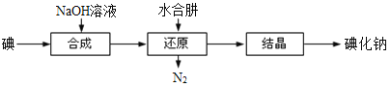
还原过程中可用硫化钠或铁屑等物质替代水合肼,但水合肼还原法制得的产品纯度更高,原因是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NOx、SO2的处理转化对环境保护有着重要意义。
(1)利用反应2NO(g)+2CO(g) = N2(g)+2CO2(g),可实现汽车尾气的无害化处理。一定条件下进行该反应,测得CO的平衡转化率与温度、起始投料比m[m=![]() ]的关系如图1所示。
]的关系如图1所示。
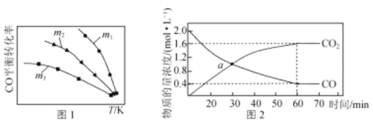
①该反应的ΔH ____0(填“>”“<”或“=”)。
②下列说法正确的是________(填字母)。
A.当体系中CO2和CO物质的量浓度之比保持不变时,反应达到平衡状态
B.投料比:m1>m2>m3
C.当投料比m=2时,NO转化率是CO转化率的2倍
D.汽车排气管中的催化剂可提高NO的平衡转化率
③随着温度的升高,不同投料比下CO的平衡转化率趋于相近的原因为________。
(2)若反应2NO(g)+2CO(g) = N2(g)+2CO2(g)的正、逆反应速率可表示为:v正=k正·c2(NO) ·c2(CO);v逆=k逆·c (N2) ·c2(CO2), k正、k逆分别为正、逆反应速率常数, 仅与温度有关。一定温度下,在体积为1L的容器中加入2molNO和2molCO发生上述反应,测得CO和CO2物质的量浓度随时间的变化如图2所示,则a点时v正∶v逆=________。
(3)工业生产排放的烟气中同时存在SO2、NOx和CO,利用它们的相互作用可将SO2、NOx还原成无害物质,一定条件下得到以下实验结果。图3为298K各气体分压(气体的物质的量分数与总压的乘积)与CO物质的量分数的关系,图4为CO物质的量分数为2.0%时,各气体分压与温度的关系。
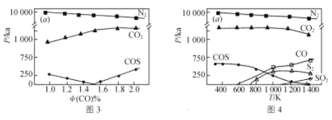
下列说法不正确的是________(填字母)。
A.不同温度下脱硝的产物为N2,脱硫的产物可能有多种
B.温度越高脱硫脱硝的效果越好
C.NOx比SO2更易被CO还原
D.体系中可能发生反应:2COS = S2+2CO;4CO2+S2 = 4CO+2SO2
(4)NH3催化还原氮氧化物是目前应用最广泛的烟气脱硝技术。用活化后的V2O5作催化剂,NH3将NO还原成N2的一种反应历程如图5所示,则总反应方程式为________。

(5)用间接电化学法去除烟气中NO的原理如图6所示,则阴极的电极反应式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组在实验室用乙醇、浓硫酸和溴化钠和水混合反应来制备溴乙烷,并探究溴乙烷的性质。有关数据见下表:
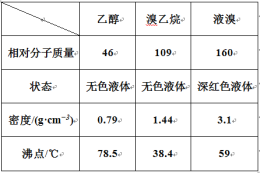
I. 溴乙烷的制备
反应原理如下,实验装置如上图(加热装置、夹持装置均省略):
H2SO4+NaBr ![]() NaHSO4+HBr↑ CH3CH2OH+HBr
NaHSO4+HBr↑ CH3CH2OH+HBr ![]() CH3CH2Br+H2O
CH3CH2Br+H2O
(1) 图甲中A 仪器的名称_____,图中B 冷凝管的作用为_____。
(2) 若图甲中A 加热温度过高或浓硫酸的浓度过大,均会使 C 中收集到的粗产品呈橙色,原因是A 中发生了副反应生成了_____;F 连接导管通入稀NaOH 溶液中,其目的主要是吸收_____等尾气防止污染空气
II. 溴乙烷性质的探究
用如图实验装置验证溴乙烷的性质:
(3) 在乙中试管内加入 10mL6mol·L -1NaOH 溶液和 2mL 溴乙烷,振荡、静置,液体分层,水浴加热。该过程中的化学方程式为_______。
(4) 若将乙中试管里的 NaOH 溶液换成NaOH 乙醇溶液,为证明产物为乙烯,将生成的气体通入如图丙装置。a 试管中的水的作用是_______;若无 a 试管,将生成的气体直接通入 b 试管中,则 b中的试剂可以为 _____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A的相对分子质量不超过150,经测定可知A具有下列性质:
A所具有的性质 | 由此推出的A的组成或结构 |
①A能燃烧,燃烧产物只有CO2和H2O | |
②A与醇或羧酸在浓硫酸存在条件下发生反应均能生成有香味的物质 | |
③在一定条件下,A能发生分子内的脱水反应,生成物能使溴的CCl4溶液退色 | |
④0.1 mol A与足量NaHCO3溶液反应放出标准状况下4.48L气体 |
(1)填写表中空白_____________、__________________ 、_______________________。
(2)已知A分子中氧元素的质量分数为59.7%,则A的分子式为______________。
(3)假设A的结构式中不含碳支链,写出③中A所发生反应的化学方程式:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据金属活动性顺序表,Cu不能发生:Cu+2H2O===Cu(OH)2+H2↑的反应,但选择恰当的电极材料和电解质溶液进行电解,这个反应就能实现。下列四组电极和电解质溶液中,能实现该反应最为恰当的一组是( )
A | B | C | D | |
阳极 | 石墨棒 | Cu | Cu | Cu |
阴极 | 石墨棒 | 石墨棒 | Fe | Pt |
电解质 溶液 | CuSO4 溶液 | Na2SO4 溶液 | H2SO4 溶液 | CuSO4 溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图实验装置用于验证某些物质的性质。在试管A中装入足量的固体NaHCO3,D为固定蚊香的硬纸片。试回答下列问题:
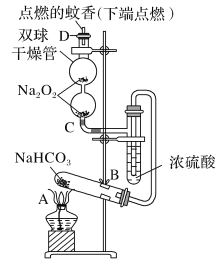
(1)在A试管内发生反应的化学方程式是_____。
(2)B装置的作用是_____。
(3)在双球干燥管内发生反应的化学方程式为____。
(4)双球干燥管内及D处观察到的实验现象是_____。
(5)若将干燥管内的Na2O2换成Na2O,则双球干燥管内及D处观察到的实验现象是:____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com