
【题目】N2H4·H2O(水合肼)极毒且不稳定,100℃以上易分解失水,常用作还原剂和除氧剂(通常生成N2和H2O),其熔点为-40℃,沸点118.5℃。现以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4·H2O和无水Na2SO3,其主要流程如下:
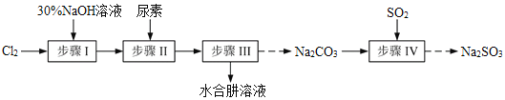
已知:Cl2(g)+2OH-(aq)=ClO-(aq)+Cl-(aq)+H2O(aq) △H<0
(1)配制30%NaOH溶液时,所需玻璃仪器除量筒、烧杯外,还需要_____________(填标号)。
A.容量瓶 B.胶头滴管 C.玻璃棒 D.锥形瓶
(2)步骤Ⅰ制备NaClO溶液时,若温度超过40℃,Cl2与NaOH溶液充分反应生成NaClO3和NaCl。实验中为控制反应温度除了用冰水浴、充分搅拌外,还需采取的措施是_______________________。
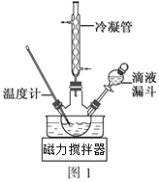
(3)步骤Ⅱ合成N2H4·H2O的装置如图1所示。NaClO碱性溶液与尿素水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应。实验中通过滴液漏斗滴加的溶液是_____________(填字母);
a.尿素溶液 b.NaClO碱性溶液 c.尿素溶液或NaClO溶液任选其一
理由是____________________________________。
(4)步骤Ⅲ中分离出N2H4·H2O应该采用的方法最合理是____________________。
(5)步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3(水溶液中H2SO3、HSO3-、SO32-随pH的分布如图2所示,Na2SO3的溶解度曲线如图3所示)。
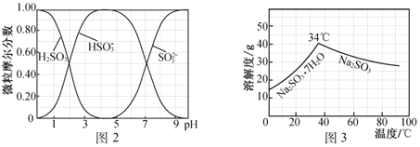
①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通SO2的方法是______________。
②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案:_________________________________,用少量无水乙醇洗涤,干燥,密封包装。
(6)工业上还可以用水合肼还原法制取碘化钠,工艺流程如图:
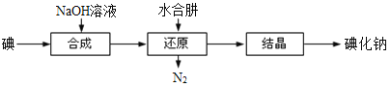
还原过程中可用硫化钠或铁屑等物质替代水合肼,但水合肼还原法制得的产品纯度更高,原因是_______________________。
【答案】BC缓慢通入Cl2b过量的NaClO溶液会将水合肼氧化减压蒸馏测量溶液的pH,若pH约为4,停止通SO2边搅拌边滴加NaOH溶液,并监测溶液pH,当pH接近10时,停止加液,将溶液转移到蒸发皿中,低温蒸发至较多晶体析出,趁热过滤(不得低于34℃)N2H4H2O的氧化产物为N2和H2O,分离产品过程容易进行
【解析】
由实验流程可知步骤Ⅰ为氯气和氢氧化钠溶液的反应,生成NaClO,生成的NaClO与尿素反应生成N2H4H2O和Na2CO3,可用蒸馏的方法分离出N2H4H2O,副产品Na2CO3溶液中通入二氧化硫,可制得Na2SO3,结合对应物质的性质以及题给信息解答该题。
(1)配制30%NaOH溶液时,需要用托盘天平称取一定量的氢氧化钠固体,如何在烧杯中加入适量的水溶解即可,所需玻璃仪器除量筒、烧杯外,还需要玻璃棒和胶头滴管,故答案为:BC;
(2)温度超过40℃,Cl2与NaOH溶液反应生成 NaClO3和NaC1,反应的离子方程式为3Cl2+6OH- ![]() ClO3-+5Cl-+3H2O,实验中控制温度计温度除用冰水浴外,还应控制通入氯气的速率,避免反应过于剧烈,放出大量的热而导致温度升高,故答案为:缓慢通入氯气;
ClO3-+5Cl-+3H2O,实验中控制温度计温度除用冰水浴外,还应控制通入氯气的速率,避免反应过于剧烈,放出大量的热而导致温度升高,故答案为:缓慢通入氯气;
(3)实验中通过滴液漏斗滴加的溶液是NaClO碱性溶液,可以避免过量的NaClO溶液会将水合肼氧化生成N2,故答案为:b;过量的NaClO溶液会将水合肼氧化;
(4)根据题意,N2H4·H2O(水合肼)不稳定,100℃以上易分解失水,熔点为-40℃,沸点118.5℃。步骤Ⅲ中分离出N2H4·H2O应该采用减压蒸馏,故答案为:减压蒸馏;
(5)用Na2CO3制备无水Na2SO3,在Na2CO3溶液中通入过量的二氧化硫生成NaHSO3,然后在NaHSO3溶液中加入NaOH溶液可生成Na2SO3。
①由图像可知,如溶液pH约为4时,可完全反应生成NaHSO3,此时可停止通入二氧化硫,可通过测量溶液pH的方法控制,故答案为:测量溶液的pH,若pH约为4,停止通SO2;
②由 NaHSO3溶液制备无水Na2SO3,可边搅拌边向NaHSO3溶液中滴加NaOH溶液,测量溶液pH,由图像可知pH约为10时,可完全反应生成Na2SO3,此时停止滴加NaOH溶液,加热浓缩溶液至有大量晶体析出,由图像3可知在高于34℃条件下趁热过滤,可得到无水Na2SO3,故答案为:边搅拌边向NaHSO3溶液中滴加NaOH溶液,测量溶液pH,pH约为10时,停止滴加NaOH溶液,加热浓缩溶液至有大量晶体析出,在高于34℃条件下趁热过滤。
(6) N2H4H2O的氧化产物为N2和H2O,而用Na2S或Fe屑还原会得到其它杂质,水合肼还原法制得的产品纯度更高,故答案为:N2H4H2O的氧化产物为N2和H2O,分离产品过程容易进行。


科目:高中化学 来源: 题型:
【题目】有机化合物A~H的转换关系如下所示:
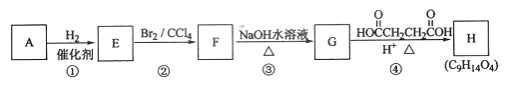
链烃A有支链且只有一个官能团,其相对分子质量在65~75之间,1 mol A完全燃烧消耗7 mol氧气,请回答下列问题:
(1)A的结构简式是________;
(2)由F转化为G的化学方程式是_______________________;
(3)G与金属钠反应能放出气体,由G转化为H的化学方程式是_______________;
(4)①的反应类型是___________;③的反应类型是____________;
(5)链烃B是A的同分异构体,分子中的所有碳原子共平面,其催化氢化产物为正戊烷,写出B任一可能的结构简式_______________________________;
(6)C也是A的一种同分异构体,它的一氯代物只有一种(不考虑立体异构,则C的结构简式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列卤代烃在KOH醇溶液中加热不发生消去反应的是( )
①![]() ②
②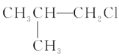 ③(CH3)3CCH2Cl ④CHCl2-CHBr2 ⑤
③(CH3)3CCH2Cl ④CHCl2-CHBr2 ⑤![]() ⑥CH3Cl
⑥CH3Cl
A.①③⑥B.②③⑤C.全部D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素 X、Y、Z、M的原子序数依次增大,它们组成一种团簇分子Z2M2Y4(YX)2,结构如图所示。X、M的族序数均等于周期序数,Y原子核外最外层电子数是其电子总数的![]() ,下列说法正确的是
,下列说法正确的是
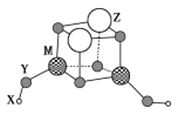
A.简单离子半径: Z>M>Y
B.常温下Z和M的单质均能溶于浓硝酸
C.X与Y结合形成的化合物是离子化合物
D.工业上常用电解Z的氯化物的熔融液来制取Z单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科研人员设想利用如图所示的装置生产硫酸,下列有关说法正确的是( )
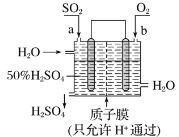
A.a 为正极,b 为负极
B.生产过程中氢离子由右移向左
C.从左下口流出的硫酸的质量分数一定大于 50%
D.负极反应式为 SO2+2H2O-2e-=SO42-+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,一种气态烷烃和一种气态烯烃的混合物18g,其密度是相同条件下H2密度的11.25倍。当混合物通过足量的溴水时,溴水增重8.4 g,则这两种气态烃是( )
A.CH4和C2H4B.C2H6和C2H4C.CH4和C3H6D.CH4和C4H8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在有机化学中广泛采用系统命名法,根据系统命名法原则,回答下列问题:
①系统命名法命名下列物质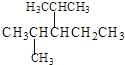 ___;
___;
②3,4-二甲基-2-戊烯的结构简式是___;
(2)![]() 中含有的官能团的名称为__。
中含有的官能团的名称为__。
(3)按要求书写下列化学方程式:
①甲苯制备TNT___;
②实验室制备乙烯___。
(4)下列物质的沸点按由高到低的顺序排列正确的是__。
①CH3(CH2)2CH3 ②CH3(CH2)3CH3 ③(CH3)3CH ④(CH3)2CHCH2CH3
A.④③②① B.②④③① C.②④①③ D.④②①③
(5)现有下列6种与人们生产生活相关的有机物:①CH3COOH(调味剂)②HCOOCH3(烟草熏蒸剂)③![]() (制酚醛树脂)④
(制酚醛树脂)④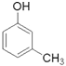 (生产杀虫剂)⑤CH2=CH-CH=CH2(合成橡胶原料)⑥HCHO(防腐剂)。其中与①互为同分异构体的是___(填序号)。
(生产杀虫剂)⑤CH2=CH-CH=CH2(合成橡胶原料)⑥HCHO(防腐剂)。其中与①互为同分异构体的是___(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.原子最外层电子数为2的元素一定处于周期表IIA族
B.水分子和氨气分子中,中心原子的杂化方式相同
C.2p能级有两个未成对电子和3p能级有两个未成对电子的原子对应的元素属于同一主族
D.M层全充满而N层为![]() 的原子对应的元素为K
的原子对应的元素为K
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】紫草宁(shikonin,见下图)是从生长在亚洲学名叫Lithospermum erythrorhizon的一种植物的根部提取出来的红色化合物。几个世纪以来用做民间药物,如今用于配制治疗跌打损伤的膏药。下列说法不正确的是( )
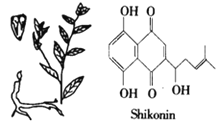
A. 紫草宁的分子式为C16H16O5
B. 等量的紫草宁与NaOH溶液、浓溴水反应,消耗NaOH、Br2 的物质的量之比为3:4
C. 紫草宁既能发生氧化反应又能发生还原反应
D. 常温下紫草宁不易溶于水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com