
����Ŀ���л�������A��H��ת����ϵ������ʾ��
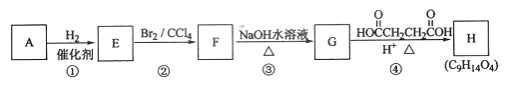
����A��֧����ֻ��һ�������ţ�����Է���������65��75֮�䣬1 mol A��ȫȼ������7 mol��������ش��������⣺
��1��A�Ľṹ��ʽ��________��
��2����Fת��ΪG�Ļ�ѧ����ʽ��_______________________��
��3��G������Ʒ�Ӧ�ܷų����壬��Gת��ΪH�Ļ�ѧ����ʽ��_______________��
��4���ٵķ�Ӧ������___________���۵ķ�Ӧ������____________��
��5������B��A��ͬ���칹�壬�����е�����̼ԭ�ӹ�ƽ�棬����⻯����Ϊ�����飬д��B��һ���ܵĽṹ��ʽ_______________________________��
��6��CҲ��A��һ��ͬ���칹�壬����һ�ȴ���ֻ��һ�֣������������칹����C�Ľṹ��ʽΪ__________________________��
���𰸡���CH3��2CHC��CH ��CH3��2CHCHBrCH2Br+2NaOH![]()
![]() +2NaBr
+2NaBr ![]() +HOOCCH2CH2COOH
+HOOCCH2CH2COOH![]()
 +2H2O �ӳɷ�Ӧ����ԭ��Ӧ�� ȡ����Ӧ CH3CH=CHCH=CH2����д����˳�����칹�壩��CH3CH2C��CCH3
+2H2O �ӳɷ�Ӧ����ԭ��Ӧ�� ȡ����Ӧ CH3CH=CHCH=CH2����д����˳�����칹�壩��CH3CH2C��CCH3 ![]()
��������
��1��G�붡���ᷴӦ����H������H�ķ���ʽ��֪��G�����к���5��̼ԭ�ӣ�������A�к���5��̼ԭ�ӣ�Aȼ�յķ���ʽΪC5Hy+(5+![]() )O2
)O2![]() 5CO2+
5CO2+![]() H2O��1 mol A��ȫȼ������7 mol������5+
H2O��1 mol A��ȫȼ������7 mol������5+![]() =7�����y=8��A�ķ���ʽ��C5H8������A��֧����ֻ��һ�������ţ�����A�Ľṹ��ʽ��(CH3)2CHC��CH��������3������1����Ȳ��
=7�����y=8��A�ķ���ʽ��C5H8������A��֧����ֻ��һ�������ţ�����A�Ľṹ��ʽ��(CH3)2CHC��CH��������3������1����Ȳ��
��2������A�Ľṹ��ʽ��֪��A��H2�����ӳɷ�Ӧ����E��E��Br2/CCl4�����ӳɷ�Ӧ����F����E�Ľṹ��ʽ��(CH3)2CHCH=CH2����F�Ľṹ��ʽ��(CH3)2CHCHBrCH2Br��F��NaOHˮ��Һ����ˮ�ⷴӦ����G��G�Ľṹ��ʽΪ![]() ��Fת��ΪG�Ļ�ѧ����ʽ�ǣ�CH3��2CHCHBrCH2Br+2NaOH
��Fת��ΪG�Ļ�ѧ����ʽ�ǣ�CH3��2CHCHBrCH2Br+2NaOH![]()
![]() +2NaBr��
+2NaBr��
��3��G����H�ķ�Ӧ��������Ӧ������H�ķ���ʽ���жϣ�HӦ���ǻ��������Է�Ӧ�ķ���ʽ��![]() +HOOCCH2CH2COOH
+HOOCCH2CH2COOH![]()
 +2H2O��
+2H2O��
��4����Ӧ�٢۵ķ�Ӧ���ͷֱ��Ǽӳɷ�Ӧ����ԭ��Ӧ����ȡ����Ӧ����ˮ�ⷴӦ����
��5������B��A��ͬ���칹�壬�����е�����̼ԭ�ӹ�ƽ�棬����⻯����Ϊ�����飬��B�Ľṹ��ʽ��CH3CH=CHCH=CH2����д����˳�����칹�壩��CH3CH2C��CCH3��
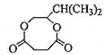
��6��CҲ��A��һ��ͬ���칹�壬����һ�ȴ���ֻ��һ�֣�˵�������ǶԳƵģ����C�Ľṹ��ʽ��![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Na2O2��Na2O�Ļ����mg���뵽������300g��ˮ����ȫ��Ӧ��,������״���µ�����224mL,�ڷ�Ӧ�����Һ�м���0. 5mol/L H2SO4��Һ100mL,ǡ���к�����Һ������,��Һ�������Ϊ400mL,���м������������( )
A.m=3.42g
B.n( Na2O2) =0. 02mol
C.n(Na2O) : n(Na2O2) =3 :2
D.�����Һ��Na2SO4��Ũ��Ϊ0. 25mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��W��X��Y��ZΪԭ���������������ǰ������Ԫ�أ�Ԫ��W����������ḻ��Ԫ�أ�Ԫ��X��ԭ�ӵ����������������ڲ��3����Ԫ��Z�Ļ�̬ԭ�Ӻ��������24���˶�״̬��Y��X��Z����ͬһ���ڣ���Ԫ��Y�Ļ�̬ԭ�Ӻ������p���ӱ�s���Ӷ�5����
(1)Z�Ļ�̬ԭ�ӵĺ�������Ų�ʽΪ_____________��
(2)Z����������ʯ�ͻ�������Ҫ�Ĵ���֮һ����������()�ѻ����ɱ��ͱ�ϩ��
��1 mol��ϩ�����к��ЦҼ���м���Ŀ֮��Ϊ_____________��
�ڱ�������̼ԭ�ӵ��ӻ��������Ϊ_____________��
��Z��һ��������ZO5�У�Z�Ļ��ϼ�Ϊ��6�ۣ������й���������ĿΪ_________����

(3)W��X��Y����Ԫ�صĵ縺����С�����˳��Ϊ_______(����Ԫ�ط��Żش�)��
(4)ZY3���۵�Ϊ1 152 �棬��������״̬���ܹ����磬�ݴ˿��ж�ZY3��������_________(�������)��
(5)ZX2����ľ����ṹ��ͼ��ʾ��ÿ��Zԭ����Χ�����Xԭ����ĿΪ________�����û��������Է�������ΪM�������߳�Ϊa pm�������ӵ�������ֵΪNA����þ�����ܶ�Ϊ_____________g/cm3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ָ�ܽ�̫����ֱ��ת���ɵ��ܵIJ��ϡ���������ֳ�̫���ܲ��ϣ�ֻ�а뵼����Ͼ������ֹ��ܡ�����̫����ز��ϵ��е����衢�ྦྷ�衢�Ǿ��衢GaAs��GaAlAs��InP��CdS��CdTe��CuInSe�ȡ�
��1����֪Se�����ڱ���λ��Ϊ_____����Ļ�̬ԭ�ӵ����Ų�ʽΪ_____,��̬Gaԭ�Ӻ������ռ�ݵ�����ܼ�Ϊ_____��ͭ�Ļ�̬ԭ�Ӽ۵����Ų�ͼΪ_____��
��2��P��S��Ga�縺�ԴӴ�С��˳��Ϊ_____��
��3����AlԪ�ش���ͬһ�������Ԫ�ؾ���ȱ�����ԣ��仯�����������мӺ��ԣ��������(H3BO3)��ˮ��Һ������ˮ��Ӧ����[B(OH)4]-������һԪ��������ʣ�[B(OH)4]-�ĽṹʽΪ____�������λ����
��4����֪[Cu(H2O)4]2+���жԳƵĿռ乹�ͣ�[Cu(H2O)4]2+�е�2��H2O��Cl-ȡ�����ܵõ�2�ֲ�ͬ�ṹ�IJ����[Cu(H2O)4]2+�Ŀռ乹��Ϊ_____��
��5��AsԪ�صĵ�һ������____SeԪ�صĵ�һ������(����ڡ�����С�ڡ����ڡ�)��ԭ����__________��
��6��̫����ز��ϵĺܶ���������������������ʱ���������Ļ�����ɫ������ԭ�ӽṹ��֪ʶ���������������ԭ����____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A-J�ֱ��ʾ��ѧ��ѧ�г�����һ�����ʣ�����֮�����ϵ��ͼ��ʾ(���ַ�Ӧ�������û���г�)������֪GΪ����Ԫ�صĹ�̬�����A��B��C��D��E��F���������о���ͬһ��Ԫ�ء�����д���пհף�
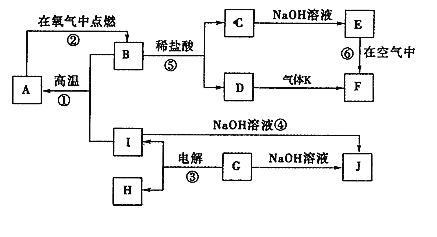
(1)A��B��C��D��E��F��������������ͬһ��Ԫ�������ڱ���λ��_________
(2)д������D��Һ�������ӵķ���____��
(3)д����Ӧ�ܵ����ӷ���ʽ________��
(4)��������K��ˮ��Һ�м������ᣬʹ��ǡ����ȫ��Ӧ��������Һ��pH_____7(����>������<������=��)�������ӷ���ʽ��ʾ��ԭ��______��
(5)��������K��0.1mol/Lˮ��Һ�м���pH=1�����ᣬ�Ұ�ˮ������������Ϊ1:1����������Һ�и��������ʵ���Ũ���ɴ�С�Ĺ�ϵ��______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2012��2�£�����������ˮ������ζ��������λ�������ε���ͨ�ȵ���������������ƿװ����ˮ�������������飬�����������������������Ż���ˮ���ŷŹܵ��ų��ı�������������ˮ��ζ����Ҫԭ�������������գ�
(1)������ˮ��ϣ���Һ����ǣ���û���Һ�еμ�NaOH��Һ���ɹ۲쵽��������____����������ӦҺ�м���ͨ�����CO2���ֿɹ۲쵽��������____����ͨ��CO2ʱ�ķ�ӦΪ_____��˵�����Ӿ���_______�ԡ�
(2)A��B�������ʵķ���ʽ����C7H8O�����Ƕ��ܸ������Ʒ�Ӧ�ų�������B��ʹ������ˮ��ɫ����������ɫ������A���ܡ�B�����ϵ�һ����������֡�
��д��A��B�Ľṹ��ʽ��A________��B_______________��
��д��B��NaOH��Һ��Ӧ�Ļ�ѧ����ʽ��_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧ�Һϳ��˺���N5+�����࣬���и����ӵ����Ǹ��ܱ�ը���ʣ������ӵĽṹ��V �Σ���ͼ��ʾ��ͼ�м�ͷ�����������������йظ����ʵ�˵������ȷ����
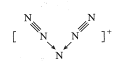
A.ÿ��Ns+�к���35�����Ӻ�36������B.��������ֻ���зǼ��Լ�
C.���������2������D.![]() ��
��![]() ��Ϊ�ȵ�����
��Ϊ�ȵ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ѧ���������ҹ����в��Ų����������������ƣ�Na2S2O8������SΪ+6�ۣ�ȥ����ˮ�е��������[As(V)]���о��ɹ����䷴Ӧ����ģ����ͼ��ʾ��Ksp[Fe(OH)3]=2.7��10-39�����������������
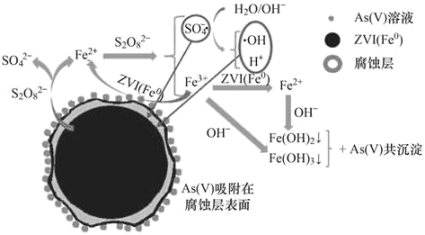
A.pHԽС��Խ������ȥ����ˮ�е��������
B.1mol�������ƣ�Na2S2O8����NA��������
C.���������£���������ɻ�������Ӧ�ķ���ʽΪ��SO4-+ OH- = SO42-+OH
D.�����£��м����Fe(OH)3����ˮ���ñ�����Һ��c(Fe3+)ԼΪ2.7��10-18mol��L-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
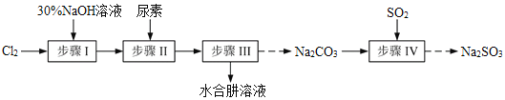
����Ŀ��N2H4��H2O��ˮ���£������Ҳ��ȶ���100�������ֽ�ʧˮ����������ԭ���ͳ�������ͨ������N2��H2O�������۵�Ϊ��40�棬�е�118.5�档����Cl2��NaOH��(NH2)2CO�����أ���SO2Ϊԭ�Ͽ��Ʊ�N2H4��H2O����ˮNa2SO3������Ҫ�������£�
��֪��Cl2(g)��2OH-(aq)=ClO-(aq)��Cl-(aq)��H2O(aq) ��H<0
��1������30%NaOH��Һʱ�����貣����������Ͳ���ձ��⣬����Ҫ_____________�����ţ���
A������ƿ B����ͷ�ι� C�������� D����ƿ
��2��������Ʊ�NaClO��Һʱ�����¶ȳ���40�棬Cl2��NaOH��Һ��ַ�Ӧ����NaClO3��NaCl��ʵ����Ϊ���Ʒ�Ӧ�¶ȳ����ñ�ˮԡ����ֽ����⣬�����ȡ�Ĵ�ʩ��_______________________��
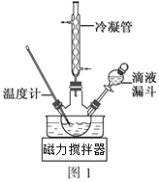
��3�������ϳ�N2H4��H2O��װ����ͼ1��ʾ��NaClO������Һ������ˮ��Һ��40�����·�Ӧһ��ʱ�����Ѹ��������110�������Ӧ��ʵ����ͨ����Һ©���μӵ���Һ��_____________������ĸ����
a��������Һ b��NaClO������Һ c��������Һ��NaClO��Һ��ѡ��һ
������____________________________________��
��4��������з����N2H4��H2OӦ�ò��õķ����������____________________��
��5��������ò����õ��ĸ���ƷNa2CO3�Ʊ���ˮNa2SO3��ˮ��Һ��H2SO3��HSO3-��SO32-��pH�ķֲ���ͼ2��ʾ��Na2SO3���ܽ��������ͼ3��ʾ����
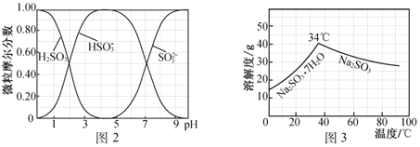
�ٱ߽������Na2CO3��Һ��ͨ��SO2�Ʊ�NaHSO3��Һ��ʵ����ȷ����ʱֹͣͨSO2�ķ�����______________��
���벹��������NaHSO3��Һ�Ʊ���ˮNa2SO3��ʵ�鷽����_________________________________����������ˮ�Ҵ�ϴ�ӣ�����ܷ��װ��
��6����ҵ�ϻ�������ˮ���»�ԭ����ȡ�⻯�ƣ�����������ͼ��
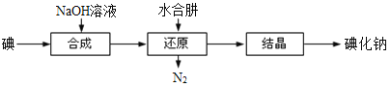
��ԭ�����п������ƻ���м���������ˮ���£���ˮ���»�ԭ���ƵõIJ�Ʒ���ȸ��ߣ�ԭ����_______________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com