
����Ŀ�����������ָ�ܽ�̫����ֱ��ת���ɵ��ܵIJ��ϡ���������ֳ�̫���ܲ��ϣ�ֻ�а뵼����Ͼ������ֹ��ܡ�����̫����ز��ϵ��е����衢�ྦྷ�衢�Ǿ��衢GaAs��GaAlAs��InP��CdS��CdTe��CuInSe�ȡ�
��1����֪Se�����ڱ���λ��Ϊ_____����Ļ�̬ԭ�ӵ����Ų�ʽΪ_____,��̬Gaԭ�Ӻ������ռ�ݵ�����ܼ�Ϊ_____��ͭ�Ļ�̬ԭ�Ӽ۵����Ų�ͼΪ_____��
��2��P��S��Ga�縺�ԴӴ�С��˳��Ϊ_____��
��3����AlԪ�ش���ͬһ�������Ԫ�ؾ���ȱ�����ԣ��仯�����������мӺ��ԣ��������(H3BO3)��ˮ��Һ������ˮ��Ӧ����[B(OH)4]-������һԪ��������ʣ�[B(OH)4]-�ĽṹʽΪ____�������λ����
��4����֪[Cu(H2O)4]2+���жԳƵĿռ乹�ͣ�[Cu(H2O)4]2+�е�2��H2O��Cl-ȡ�����ܵõ�2�ֲ�ͬ�ṹ�IJ����[Cu(H2O)4]2+�Ŀռ乹��Ϊ_____��
��5��AsԪ�صĵ�һ������____SeԪ�صĵ�һ������(����ڡ�����С�ڡ����ڡ�)��ԭ����__________��
��6��̫����ز��ϵĺܶ���������������������ʱ���������Ļ�����ɫ������ԭ�ӽṹ��֪ʶ���������������ԭ����____��
���𰸡���������VIA�� 1s22s22p63s23p2����[Ne]3s23p2 4p 3d104s1 S��P��Ga 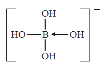 ƽ���ı��� ���� �� ��
ƽ���ı��� ���� �� ��
��������
��1��Se��34��Ԫ�أ�4�����Ӳ㡢�����6�����ӣ��������14�����ӣ������������ԭ����д��ԭ�Ӻ�������Ų�ʽ�������������ԭ����������Ӵӵ��ܼ�����ܼ��Ų��������������ԭ�������ع������ͭ�Ļ�̬ԭ�Ӽ۵����Ų�ͼ��
��2��ͬ����Ԫ�ش����ҵ縺��������ͬ����Ԫ�ش��ϵ��µ縺�Լ�С��
��3��H3BO3��ˮ��Ӧ����[B(OH)4]-ʱ�γ�1����λ����
��4��[Cu��NH3��4]2+���жԳƵĿռ乹�ͣ������Ϊ��������ṹ��ƽ�������νṹ��ƽ�������νṹ�����ֲ�ͬ�Ķ��ȴ����������ṹ��һ�ֶ��ȴ��
��5���顢�����ǵ�4���ڷǽ���Ԫ�أ�ͬһ����Ԫ��������ҵ�һ�����ܳ��������ƣ�����Ԫ��ԭ��4p�ܼ��ǰ����ȶ�״̬�������ϵͣ���һ�����ܸ���ͬ��������Ԫ�أ�
��6������̬ԭ�ӵĵ��������������ӻ�ԾǨ���ϸ��ܼ�����ɼ���̬ԭ�ӣ����Ӵӽϸ������ļ���̬ԾǨ���ϵ������ļ���̬������̬ʱ�����Թ����ʽ�ͷ�������
��1��Se��34��Ԫ�أ�4�����Ӳ㡢�����6�����ӣ������ڱ���λ��Ϊ��������VIA�壻�������14�����ӣ������������ԭ������ԭ�Ӻ�������Ų�ʽ��1s22s22p63s23p2�� Ga��31��Ԫ�أ�������31�����ӣ���̬Gaԭ�ӵ����Ų�ʽΪ1s22s22p63s23p63d104s24p1������ܼ�Ϊ4p�������������ԭ�������ع���ͭ�Ļ�̬ԭ�Ӽ۵����Ų�ͼ��3d104s1��
��2��ͬ����Ԫ�ش����ҵ縺��������ͬ����Ԫ�ش��ϵ��µ縺�Լ�С�����Ե縺��S��P��Ga��
��3��H3BO3��ˮ��Ӧ����[B(OH)4]-ʱ�γ�1����λ����[B(OH)4]-�ĽṹʽΪ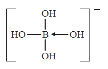 ��
��
��4��[Cu��NH3��4]2+���жԳƵĿռ乹�ͣ������Ϊ��������ṹ��ƽ�������νṹ��ƽ�������νṹ�����ֲ�ͬ�Ķ��ȴ����������ṹ��һ�ֶ��ȴ��[Cu(H2O)4]2+�е�2��H2O��Cl-ȡ�����ܵõ�2�ֲ�ͬ�ṹ�IJ����[Cu(H2O)4]2+�Ŀռ乹��Ϊƽ���ı��Σ�
��5���顢�����ǵ�4���ڷǽ���Ԫ�أ�ͬһ����Ԫ��������ҵ�һ�����ܳ��������ƣ�����Ԫ��ԭ��4p�ܼ��ǰ����ȶ�״̬�������ϵͣ���һ�����ܸ���ͬ��������Ԫ�أ�����AsԪ�صĵ�һ�����ܴ���SeԪ�صĵ�һ�����ܣ�
��6������̬ԭ�ӵĵ��������������ӻ�ԾǨ���ϸ��ܼ�����ɼ���̬ԭ�ӣ����Ӵӽϸ������ļ���̬ԾǨ���ϵ������ļ���̬������̬ʱ�����Թ����ʽ�ͷ���������������Ļ�����ɫ��


 �߽�������ϵ�д�
�߽�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ�������5 minʱ�����ͭ�缫����������2.16 g���Իش�

��1����Դ��Y����____(����������������)����C�����缫�����ĵ缫��Ӧʽ��___
��2��ͨ��5 minʱ��B�й��ռ���224 mL(��״��)���壬B�����������ĵ缫��Ӧʽ___����Һ���Ϊ200 mL(���ǰ����Һ������仯���Բ���)����ͨ��ǰc(CuSO4)��______��
��3����A��KCl��Һ�����Ҳ��200 mL��������Һ������Cl��������5 min��,��������������Ϊ����״����___����ʱ��Һc(OH-)��_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NF3�������������ڳ��³�ѹ������ɫ����ζ�����壬�����ӹ�ҵ��һ�������ĵ�����ʴ�����塣�ش��������⣺
��1��NF3�ĵ���ʽΪ______��NԪ�صĻ��ϼ�Ϊ______��
��2��F2��NH3ֱ�ӷ�Ӧ����NF3�Ļ�ѧ����ʽΪ______��
��3��ʵ����ģ�ҵ�����õ������NH4HF2��NH4FHF������ȡNF3������Ϊ��NiΪ�������ϵĺϽ��ں����������������������������ķ�Ӧ��������Ϊ̼�ظ֣�����Һ�ɻ��������á�
�ٵ��ʱNF3��______�����ɣ�����������������______���ѧʽ����
�ڵ����Һ����Ni����Fe��Cu�ĵ��ʼ�NH4HF2�ȣ��ɾ��������̽��л��������ã�
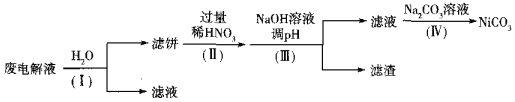
��֪��ʵ�������£����ֽ������ӿ�ʼ�����������ȫ��pH���±�
�������� | Ni2+ | Fe2+ | Cu2+ | Fe3+ |
��ʼ����ʱ��pH | 7.2 | 7.0 | 4.7 | 1.9 |
������ȫʱ��pH | 9.2 | 9.0 | 6.7 | 3.2 |
����I��Ŀ����______��������˱���Ni������������ӷ���ʽΪ______��HNO3�Ļ�ԭ����ΪNO������������pHʱ��������pHӦ���Ƶķ�Χ��______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�Ͽ���ͨ�����NO2�Ʊ�NH4NO3���乤��ԭ����ͼ��ʾ������˵����ȷ����
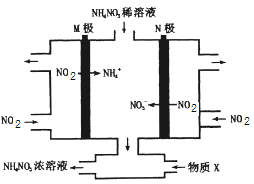
A. �������У�������NO2�������ʱ�������NO2�������ʿ�Щ
B. ����������1molNO2�貹��6mol������X
C. ������ӦΪ��NO2+e-+H2O=NO3-+2H+
D. ����������������pH����������pH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ö��Ե缫�缫500mlKCl��Cu(NO3)2��ɵĻ����Һ��һ��ʱ����������õ�22.4L(��״����)���壬������Һ��Ͼ��Ⱥ�����ԣ������Һ��NO3-�����ʵ�Ũ��Ϊ
A. 2mol��L-1B. 1.2mol��L-1C. 4mol��L-1D. 1mol��L-1 .
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)��֪��2L�Ĺ̶��ݻ����ܱ������н������п��淴Ӧ�������ʵ��й��������£�
3A (g) + B (g)![]() 2C(g)
2C(g)
��ʼ���ʵ���Ũ�ȣ�mol/L����1.5 1 0
2sĩ���ʵ���Ũ�ȣ�mol/L����0.9 0.8 0.4
��0��2s������C����ʾ�ķ�Ӧ����Ϊ_________________��
�ڴӷ�Ӧ��ʼ��2sĩ��B��ת����Ϊ________________��
��������ʵ���ܹ�˵��������Ӧ�ڸ��������Ѿ��ﵽ��ѧƽ��״̬����_______��
A�������ƽ����Է����������ֲ���
B��������������ܶȲ���
C���������������ѹǿ���ֲ���
D��vA�UvB�UvC=3�U2�U2
E������������C�����ʵ����������ֲ���
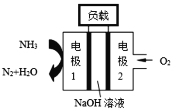
(2)��п�����������Ǧ���أ����Ĺ��ɲ�����п��������ij�ֵ������Һ���������ܷ�Ӧʽ�ǣ�2Zn+O2=2ZnO����õ�صĸ���������_________������������0.4 mol����ͨ��ʱ�����������ĵ�O2�ڱ�״���µ������_______ L��
�����ASES��˾��Ƶ�����������DZͧ��Һ��-Һ��ȼ�ϵ��ʾ��ͼ���ң���ȼ�ϵ�ع���ʱ�����·�е��������Ǵӵ缫_____���缫_____����ص��ܷ�ӦΪ______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���������Ȼ�ѧ����ʽ��2H2(g) + O2(g) = 2H2O(1) ��H= -571.6 kJmol-1��C3H8(g) + 5O2(g)= 3CO2(g) + 4H2O(l) ��H= -2220 kJmol-1������˵����ȷ����( )
A.��ͬ����H2��C3H8�ֱ���ȫȼ�գ�C3H8�ų���������
B.C3H8 ��ȫȼ������1mol H2O(l)�ų�������Ϊ555 kJ
C.l mol H2��2 molC3H8 ��ɵĻ��������ȫȼ�շų�������Ϊ5011.6 kJ
D.H2��C3H8�Ļ�����干4mol����ȫȼ��ʱ�ų�3256 kJ�������� n(H2)��n(C3H8)=1:1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϳ������������������裨![]() ����ˮ��һ�������£�������
����ˮ��һ�������£�������![]() ��Ӧ���������塣����˵������ȷ����
��Ӧ���������塣����˵������ȷ����
A. ![]() ��̼Ԫ�صĻ��ϼ�Ϊ+2
��̼Ԫ�صĻ��ϼ�Ϊ+2
B. �÷�Ӧ�IJ���֮һ������![]()
C. ��1mol![]() ���뷴Ӧʱ��ת��
���뷴Ӧʱ��ת��![]()
D. ������0.1mol![]() �ķ�ˮ����������Ҫ���ı�״����
�ķ�ˮ����������Ҫ���ı�״����![]() �����Ϊ5.6L
�����Ϊ5.6L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��M��R��X��Y��ZΪԭ��������������Ķ���������Ԫ�أ�M��̬ԭ��L����p�����������s��������2����R��ͬ����Ԫ��������õĽ���Ԫ�أ�Y��M�γɵ�һ�ֻ������������������Ҫ������Ⱦ�X��ԭ�Ӻ�����3�������ӡ���ش��������⣺
(1)R��̬ԭ�ӵĵ����Ų�ʽ��______________��X��Y��Z�縺����С�����˳����_______(��Ԫ�ط���)
(2)Y���⻯�����Ҵ��е��ܽ��С��M���⻯���ԭ����______________
(3)�� H2O�����У�H��O��H�ļ�����_________��H3O+��H��O��H���DZ�H2O��H��O��H����________������С�������)��ԭ��Ϊ________________________________
(4)Y��M�γɵ�YM3���ӵĿռ乹����____________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com