
【题目】(1)已知在2L的固定容积的密闭容器中进行下列可逆反应,各物质的有关数据如下:
3A (g) + B (g)![]() 2C(g)
2C(g)
起始物质的量浓度(mol/L):1.5 1 0
2s末物质的量浓度(mol/L):0.9 0.8 0.4
则:①0到2s用物质C来表示的反应速率为_________________;
②从反应开始到2s末,B的转化率为________________;
③下列事实不能够说明上述反应在该条件下已经达到化学平衡状态的是_______。
A.气体的平均相对分子质量保持不变
B.容器内气体的密度不变
C.容器内气体的总压强保持不变
D.vA︰vB︰vC=3︰2︰2
E.容器内气体C的物质的量分数保持不变
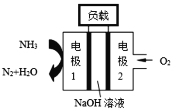
(2)①锌电池有望代替铅蓄电池,它的构成材料是锌、空气、某种电解质溶液,发生的总反应式是:2Zn+O2=2ZnO。则该电池的负极材料是_________;当导线中有0.4 mol电子通过时,理论上消耗的O2在标准状况下的体积是_______ L。
②瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图如右,该燃料电池工作时,外电路中电流方向是从电极_____到电极_____;电池的总反应为______________________。
【答案】0.2 mol/(L·s) 20% BD 锌 2.24 2 1 4NH3+3O2=2N2+6H2O
【解析】
(1)①v(C)=![]() = 0.2 mol/(L·s),故答案为:0.2 mol/(L·s);
= 0.2 mol/(L·s),故答案为:0.2 mol/(L·s);
②反应开始到2s,![]() c(B)=1mol/L-0.8mol/L=0.2mol/L,所以,B的转化率=
c(B)=1mol/L-0.8mol/L=0.2mol/L,所以,B的转化率=![]() =20%,故答案为:20%;
=20%,故答案为:20%;
③3A (g) + B (g)![]() 2C(g):
2C(g):
A.气体总质量m不变,气体的平均相对分子质量保持不变,则M不变,由n=![]() 可知,气体的总物质的量n不变,说明已平衡,A错误;
可知,气体的总物质的量n不变,说明已平衡,A错误;
B.容器体积V不变,气体总质量m不变,由![]() 可知,无论是否平衡密度均不变,即密度不变,不能说明反应是否平衡,B正确;
可知,无论是否平衡密度均不变,即密度不变,不能说明反应是否平衡,B正确;
C.正反应是气体分子数减小的反应,当容器内气体的总压强保持不变,说明反应已平衡,C错误;
D.反应速率之比=化学计量数之比,即无论是否达到平衡,都有vA︰vB︰vC=3︰2︰2,那么,当vA︰vB︰vC=3︰2︰2时,无法说明反应是否已达平衡,D正确;
E.容器内气体C的物质的量分数保持不变,说明反应已达平衡,E错误;
综上所述,BD符合题意,故答案为:BD;
(2)①Zn元素化合价升高,失电子,则锌为该电池的负极材料。由2Zn+O2=2ZnO可知,每1molO2参与反应时,转移4mol电子,当导线中有0.4 mol电子通过时,消耗O2的物质的量=0.1mol,对应的体积=0.1mol×22.4L/mol=2.24L,故答案为:锌;2.24L;
②结合图可知,NH3失电子,发生氧化反应得到N2和H2O,说明电极1为负极,则电极2位正极,所以,电流方向为:电极2→负载→电极1。该电池的反应物为NH3和O2,生成物为N2和H2O,则该电池的总反应为:4NH3+3O2=2N2+6H2O,故答案为:2;1;4NH3+3O2=2N2+6H2O。


 应用题作业本系列答案
应用题作业本系列答案 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
【题目】某有机物结构简式为 ,下列叙述不正确的是( )
,下列叙述不正确的是( )
A. 1mol该有机物在加热和催化剂作用下,最多能和4molH2反应
B. 该有机物能使溴水褪色,也能使酸性KMnO4溶液褪色
C. 该有机物的分子式为C11H15Cl
D. 该有机物在一定条件下能发生消去反应或取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关装置图的叙述正确的是
A. 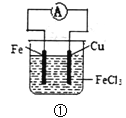 装置①中的总反应为:Cu+2Fe3+=Cu2++2Fe2+
装置①中的总反应为:Cu+2Fe3+=Cu2++2Fe2+
B. 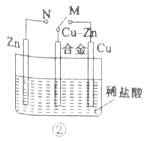 装置②中的开关由M改置于N时,Cu-Zn合金的腐蚀速度增大
装置②中的开关由M改置于N时,Cu-Zn合金的腐蚀速度增大
C.  装置③中在Fe电极区无蓝色沉淀,该方法叫牺牲阳极的阴极保护法
装置③中在Fe电极区无蓝色沉淀,该方法叫牺牲阳极的阴极保护法
D. 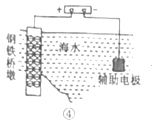 装置④中桥墩与外加电源正极连接能确保桥墩不被腐蚀
装置④中桥墩与外加电源正极连接能确保桥墩不被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组设计的用化学电源使LED灯发光,装置如图。下列说法错误的是![]()
![]()

A.铜片表面有气泡生成
B.装置中存在“化学能→电能→光能”的转换
C.如果将铝片换成银片,电路中的电流方向相反
D.如果将硫酸换成NaOH溶液,LED灯也会发光
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光伏材料是指能将太阳能直接转换成电能的材料。光伏材料又称太阳能材料,只有半导体材料具有这种功能。可做太阳电池材料的有单晶硅、多晶硅、非晶硅、GaAs、GaAlAs、InP、CdS、CdTe、CuInSe等。
(1)已知Se在周期表的位置为_____,硅的基态原子电子排布式为_____,基态Ga原子核外电子占据的最高能级为_____,铜的基态原子价电子排布图为_____。
(2)P、S、Ga电负性从大到小的顺序为_____。
(3)与Al元素处于同一主族的硼元素具有缺电子性,其化合物往往具有加合性,因而硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]-而体现一元弱酸的性质,[B(OH)4]-的结构式为____(标出配位键)
(4)已知[Cu(H2O)4]2+具有对称的空间构型,[Cu(H2O)4]2+中的2个H2O被Cl-取代,能得到2种不同结构的产物,则[Cu(H2O)4]2+的空间构型为_____。
(5)As元素的第一电离能____Se元素的第一电离能(填“大于”、“小于”或“等于”),原因是__________。
(6)太阳电池材料的很多金属或金属化合物在灼烧时会产生特殊的火焰颜色,请用原子结构的知识阐述产生此现象的原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,有100 mL pH=2的两种一元酸x和y,稀释过程中pH与溶液体积的关系如下图所示,则:

A. x为强酸,y为弱酸
B. 随着稀释的进行,y的电离程度减小
C. 稀释前x、y的物质的量浓度相等
D. 稀释后的x、y分别分别与足量的锌反应,y放出的氢气多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法中正确的数目是
①12.0g熔融的NaHSO4中含有的阳离子数为0.2NA
②1mol Na2O 和Na2O2混合物中含有的阴、阴离子总数是3NA
③常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA
④7.8g![]() 中含有的碳碳双键数目为0.3NA
中含有的碳碳双键数目为0.3NA
⑤用1L1.0 mol/LFeCl3溶液制备氢氧化铁胶体,所得氢氧化铁胶粒的数目为NA
⑥1mol SO2与足量O2在一定条件下充分反应生成SO3,共转移2NA个电子
⑦在反应KIO3+6HI=KI+3I2 +3H2O 中,每生成3molI2转移的电子数为5NA
⑧常温常压下,17 g甲基(-14CH3)中所含的中子数为9NA
A. 3 B. 4 C. 5 D. 6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA是阿伏加德罗常数的值,下列说法错误的是
A. 3g 3He含有的中子数为1NA
B. 1 L 0.1 mol·L1磷酸钠溶液含有的![]() 数目为0.1NA
数目为0.1NA
C. 1 mol K2Cr2O7被还原为Cr3+转移的电子数为6NA
D. 48 g正丁烷和10 g异丁烷的混合物中共价键数目为13NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com