
����Ŀ����NA��ʾ�����ӵ�������ֵ������˵������ȷ����Ŀ��
��12.0g���ڵ�NaHSO4�к��е���������Ϊ0.2NA
��1mol Na2O ��Na2O2�����������������������3NA
�۳��³�ѹ�£�92g��NO2��N2O4������庬�е�ԭ����Ϊ6NA
��7.8g![]() �к��е�̼̼˫����ĿΪ0.3NA
�к��е�̼̼˫����ĿΪ0.3NA
����1L1.0 mol/LFeCl3��Һ�Ʊ������������壬��������������������ĿΪNA
��1mol SO2������O2��һ�������³�ַ�Ӧ����SO3����ת��2NA������
���ڷ�ӦKIO3+6HI=KI+3I2 +3H2O �У�ÿ����3molI2ת�Ƶĵ�����Ϊ5NA
�ೣ�³�ѹ�£�17 g��(��14CH3)��������������Ϊ9NA
A. 3 B. 4 C. 5 D. 6
���𰸡�A
����������n��NaHSO4��=![]() =0.1mol��NaHSO4������״̬�µĵ��뷽��ʽΪNaHSO4=Na++HSO4-��12.0g���ڵ�NaHSO4�к��е����������ʵ���Ϊ0.1mol������������Na2O��Na2O2�����������Ӹ���֮�ȶ�Ϊ1:2��1molNa2O��Na2O2������к��е����������������ʵ���Ϊ3mol������ȷ����NO2��N2O4��ʵ��ʽ����NO2��n��NO2��=
=0.1mol��NaHSO4������״̬�µĵ��뷽��ʽΪNaHSO4=Na++HSO4-��12.0g���ڵ�NaHSO4�к��е����������ʵ���Ϊ0.1mol������������Na2O��Na2O2�����������Ӹ���֮�ȶ�Ϊ1:2��1molNa2O��Na2O2������к��е����������������ʵ���Ϊ3mol������ȷ����NO2��N2O4��ʵ��ʽ����NO2��n��NO2��=![]() =2mol�����³�ѹ��92g��NO2��N2O4�������������ԭ�����ʵ���Ϊ6mol������ȷ�������в���̼̼˫��������������n��FeCl3��=1.0mol/L
=2mol�����³�ѹ��92g��NO2��N2O4�������������ԭ�����ʵ���Ϊ6mol������ȷ�������в���̼̼˫��������������n��FeCl3��=1.0mol/L![]() 1L=1mol�����ݷ�ӦFeCl3+3H2O
1L=1mol�����ݷ�ӦFeCl3+3H2O![]() Fe��OH��3�����壩+3HCl������1molFe��OH��3����������������һ����ĿFe��OH��3�ļ����壬�����������������ʵ���С��1mol��������������1molSO2ȫ����Ӧ��ת��2mol��������SO2��O2�ķ�Ӧ�ǿ��淴Ӧ��1molSO2������O2��һ�������³�ַ�Ӧ����SO3��ת�Ƶ������ʵ���С��2mol��������������˫���ŷ����÷�Ӧ��
Fe��OH��3�����壩+3HCl������1molFe��OH��3����������������һ����ĿFe��OH��3�ļ����壬�����������������ʵ���С��1mol��������������1molSO2ȫ����Ӧ��ת��2mol��������SO2��O2�ķ�Ӧ�ǿ��淴Ӧ��1molSO2������O2��һ�������³�ַ�Ӧ����SO3��ת�Ƶ������ʵ���С��2mol��������������˫���ŷ����÷�Ӧ��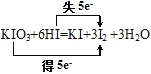 ��ÿ����3molI2ת��5mol����������ȷ����n��-14CH3��=
��ÿ����3molI2ת��5mol����������ȷ����n��-14CH3��=![]() =1mol�������������ʵ���Ϊ8mol������������ȷ�����ڢۢ�����ѡA��
=1mol�������������ʵ���Ϊ8mol������������ȷ�����ڢۢ�����ѡA��


 �Ƹ�С״Ԫͬ������������ϵ�д�
�Ƹ�С״Ԫͬ������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�������������ʢ�ŵ�Һ����( )
A. ϡ���� B. CuSO4��Һ C. FeCl3��Һ D. NaOH��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʵ�����п�����ͼ��ʾװ����ȡ����ء��������ƺ�̽����ˮ�����ʡ�ͼ�У�
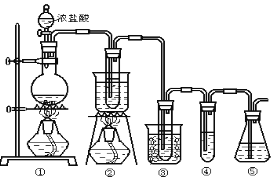
��Ϊ��������װ�ã��ڵ��Թ���ʢ��15mL30��KOH��Һ����������ˮԡ�У��۵��Թ���ʢ��15mL8%NaOH��Һ�������ڱ�ˮԡ�У��ܵ��Թ��������ɫʯ����Һ����Ϊβ������װ�á�����д���пհף�
(1)��ȡ����ʱ������ƿ�����һ�����Ķ������̣�ͨ��_________(��д��������)����ƿ�м���������Ũ���ᡣʵ��ʱΪ�˳�ȥ�����е��Ȼ������壬���ڢ����֮�䰲װʢ��____________(��д���б����ĸ)�ľ���װ�á�
A����ʯ�� B������ʳ��ˮ C��Ũ���� D������̼��������Һ
(2)�Ƚ���ȡ����غʹ������Ƶ����������ߵIJ�����_____________����Ӧ��Ͼ���ȴ�ڵ��Թ����д�������������ͼ�з��ϸþ����ܽ�����ߵ���_______(��д�����ĸ)���Ӣڵ��Թ��з�����þ���ķ�����_________(��дʵ���������)��
(3)��ʵ������ȡ�������Ƶ����ӷ���ʽ�ǣ�_______________________��
(4)ʵ���пɹ۲쵽�ܵ��Թ�����Һ����ɫ���������±仯����ɫ��______��_______������ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ�к��зḻ��þ��Դ��ijͬѧ����˴�ģ�⺣ˮ���Ʊ�MgO��ʵ�鷽����
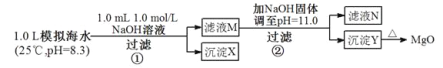
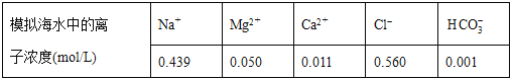
ע����Һ��ij�����ӵ�Ũ��С��1.0��10��5mol/L������Ϊ�����Ӳ����ڣ�ʵ������У�������Һ������䡣
��֪��Ksp(CaCO3)��4.96��10��9��Ksp(MgCO3)��6.82��10��6��Ksp[Ca(OH)2]��4.68��10��6��Ksp[Mg(OH)2]��5.61��10��12������˵����ȷ����( )
A. ������XΪCaCO3
B. ��ҺM�д���Mg2����������Ca2��
C. ��ҺN�д���Mg2����Ca2��
D. �����������Ϊ����4.2 g NaOH���壬������YΪCa(OH)2��Mg(OH)2�Ļ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ģ�������N������ʹ������ҩ�����ã���ϳ�·�����£�

��1��A��ϵͳ����Ϊ____________��E�й����ŵ�����Ϊ____________��
��2��A��B�ķ�Ӧ����Ϊ____________���ӷ�Ӧ����Һ̬�л���������ᴿB�ij��÷���Ϊ____________��
��3��C��D�Ļ�ѧ����ʽΪ________________________��
��4��C��ͬ���칹��W�������������칹���ɷ���������Ӧ����1 mol W�����2 mol NaOH������Ӧ������֮һ�ɱ������ɶ�Ԫȩ����������������W��____________�֣���W�ĺ˴Ź�������������壬����ṹ��ʽΪ____________��
��5��F��G�Ĺ�ϵΪ������ţ�____________��
a��̼���칹 b���������칹 c��˳���칹 d��λ���칹
��6��M�Ľṹ��ʽΪ____________��
��7�����������ϳ�·�ߣ���![]() Ϊԭ�ϣ��������·����Ʊ�ҽҩ�м���
Ϊԭ�ϣ��������·����Ʊ�ҽҩ�м���![]() ��
��

��·�����Լ�������1Ϊ____________��X�Ľṹ��ʽΪ____________��
�Լ�������2Ϊ____________��Y�Ľṹ��ʽΪ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
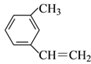
����Ŀ����1�����и��������У�����ͬϵ�����_____������ͬ���칹�����____��
A��CH3CH2CH2CHO �� ![]() B��
B��![]() ��
�� ![]()
C��![]() ��
�� ![]() D��
D��![]() ��
�� ![]()
E��![]() ��
��![]() F����ϩ�뻷����
F����ϩ�뻷����
(2) ��ϵͳ�����������������ʣ�
��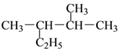 __________________�� ��
__________________�� �� ________________��
________________��
��(CH3)2C=CHCH=CH2 _____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ���������;���ж�Ӧ��ϵ����
A. Fe2(SO4)3������ˮ����������ˮ��
B. Na2CO3��Һ�Լ��ԣ�����������ȥ����
C. HF��Һ�������ԣ�������������ʴ�̼�
D. FeCl3��Һ�����ԣ�������ͭ�Ƶ�·��ĸ�ʴ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰС�������ࣨ��Ҫ�ɷ�ΪFe2O3��FeO������Fe���Ʊ�Fe3O4���ײ��ϵ�����ʾ��ͼ���£�


��֪��������У���ͬ�����²��Fe3O4�IJ�����R( )�Ĺ�ϵ��ͼ��ʾ��
)�Ĺ�ϵ��ͼ��ʾ��
��1��Ϊ��߲���ٵķ�Ӧ���ʣ��ɲ�ȡ�Ĵ�ʩ��_______________(��дһ��) ��
��2��������У���Ҫ��Ӧ�����ӷ���ʽ��________________________��
��3����ҺD����Ԫ����FeOOH��ʽ���ڡ�������У���Ӧ�Ļ�ѧ����ʽ��___________________��������У���Ӧ��ɺ����ټ���һ��ʱ���ȥʣ��H2O2Ŀ����____________________________
��4���ݷ�Ӧ�����ӷ���ʽΪ_________________ ��������е��������������IJ�����______________________��
��5������ҺD��FeOOH�����ʵ���Ϊamol����ҺB�е���Ԫ�ص����ʵ���Ϊbmol��ΪʹFe3O4�IJ�����ߣ���![]() ��_________��������ֵ��С�������3λ��
��_________��������ֵ��С�������3λ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧС���Ա�����Ϊԭ�ϣ���ȡ�������������֪�й����ʵķе����±���
���� | �״� | ������ | ��������� |
�е㣯�� | 64.7 | 249 | 199.6 |
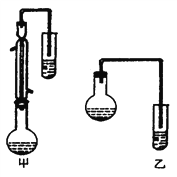
I���ϳɱ���������ֲ�Ʒ
��Բ����ƿ�м���12.2g �������20 mL �״����ܶ�Լ0.79g �� mL��1) ����С�ļ���3 mL Ũ���ᣬ���Ⱥ�Ͷ�뼸�����Ƭ��С�ļ���ʹ��Ӧ��ȫ���ñ���������ֲ�Ʒ��
(1)Ũ�����������_________������Ӧ����ˮ��������ͬλ��18O��д���ܱ�ʾ��Ӧǰ��18Oλ�õĻ�ѧ����ʽ��__________________��
(2)������λͬѧ�ֱ����������ͼ����ʵ���Һϳɱ����������װ�ã��г������ͼ�������������ȥ���������л���ķе㣬��ò���_________װ�ã���ס����ҡ�����������___________________��
(3)��Ӧ��CH3 OH Ӧ������������__________________________________��
II���ֲ�Ʒ�ľ���
(4)����������ֲ�Ʒ���������������״������ᡢ�������ˮ�ȣ��ְ���������ͼ���о��ƣ���������ͼ��������������ǡ����������������______________��
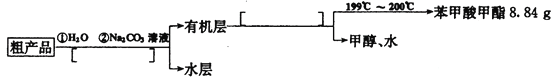
(5)ͨ�����㣬����������IJ���Ϊ_________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com