
【题目】(题文)化合物N具有镇痛、消炎等药理作用,其合成路线如下:

(1)A的系统命名为____________,E中官能团的名称为____________。
(2)A→B的反应类型为____________,从反应所得液态有机混合物中提纯B的常用方法为____________。
(3)C→D的化学方程式为________________________。
(4)C的同分异构体W(不考虑手性异构)可发生银镜反应:且1 mol W最多与2 mol NaOH发生反应,产物之一可被氧化成二元醛。满足上述条件的W有____________种,若W的核磁共振氢谱具有四组峰,则其结构简式为____________。
(5)F与G的关系为(填序号)____________。
a.碳链异构 b.官能团异构 c.顺反异构 d.位置异构
(6)M的结构简式为____________。
(7)参照上述合成路线,以![]() 为原料,采用如下方法制备医药中间体
为原料,采用如下方法制备医药中间体![]() 。
。

该路线中试剂与条件1为____________,X的结构简式为____________;
试剂与条件2为____________,Y的结构简式为____________。
【答案】 1,6-己二醇 碳碳双键,酯基 取代反应 减压蒸馏(或蒸馏)  5
5 ![]() c
c ![]() HBr,△
HBr,△ ![]() O2/Cu或Ag,△
O2/Cu或Ag,△ ![]()
【解析】分析:本题实际没有什么需要推断的,题目中已经将每一步的物质都给出了,所以只需要按部就班的进行小题的逐一解答即可。
详解:(1)A为6个碳的二元醇,在第一个和最后一个碳上各有1个羟基,所以名称为1,6-己二醇。明显E中含有碳碳双键和酯基两个官能团。
(2)A→B的反应是将A中的一个羟基替换为溴原子,所以反应类型为取代反应。反应后的液态有机混合物应该是A、B混合,B比A少一个羟基,所以沸点的差距应该较大,可以通过蒸馏的方法分离。实际生产中考虑到A、B的沸点可能较高,直接蒸馏的温度较高可能使有机物炭化,所以会进行减压蒸馏以降低沸点。
(3)C→D的反应为C与乙醇的酯化,所以化学方程式为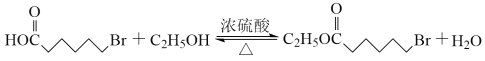 。注意反应可逆。
。注意反应可逆。
(4)C的分子式为C6H11O2Br,有一个不饱和度。其同分异构体可发生银镜反应说明有醛基;1 mol W最多与2 mol NaOH发生反应,其中1mol是溴原子反应的,另1mol只能是甲酸酯的酯基反应(不能是羧基,因为只有两个O);所以得到该同分异构体一定有甲酸酯(HCOO-)结构。又该同分异构体水解得到的醇应该被氧化为二元醛,能被氧化为醛的醇一定为-CH2OH的结构,其他醇羟基不可能被氧化为醛基。所以得到该同分异构体水解必须得到有两个-CH2OH结构的醇,因此酯一定是HCOOCH2-的结构,Br一定是-CH2Br的结构,此时还剩余三个饱和的碳原子,在三个饱和碳原子上连接HCOOCH2-有2种可能: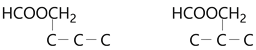 ,每种可能上再连接-CH2Br,所以一共有5种:
,每种可能上再连接-CH2Br,所以一共有5种: 。其中核磁共振氢谱具有四组峰的同分异构体,要求有一定的对称性,所以一定是
。其中核磁共振氢谱具有四组峰的同分异构体,要求有一定的对称性,所以一定是 。
。
(5)F为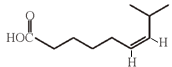 ,G为
,G为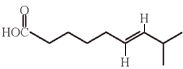 ,所以两者的关系为顺反异构,选项c正确。
,所以两者的关系为顺反异构,选项c正确。
(6)根据G的结构明显得到N中画圈的部分为M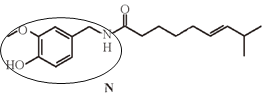 ,所以M为
,所以M为![]() 。
。
(7)根据路线中化合物X的反应条件,可以判断利用题目的D到E的反应合成。该反应需要的官能团是X有Br原子,Y有碳氧双键。所以试剂与条件1是HBr,△;将![]() 取代为
取代为![]() ,X为
,X为![]() 。试剂与条件2是O2/Cu或Ag,△;将
。试剂与条件2是O2/Cu或Ag,△;将![]() 氧化为
氧化为![]() ,所以Y为
,所以Y为![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列关于金属的说法正确的是
A.钠与氧气反应时,产物是由氧气的用量决定的
B.铝箔在空气中受热可以熔化滴落
C.铜可以在加热的条件下和氧气反应,生成氧化铜
D.铁与水蒸气反应的产物是黑色的Fe2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用吸附了氢气的纳米碳管等材料制作的二次电池的原理如图所示.下列说法正确的是( )

A. 放电时,OH﹣向镍电极作定向移动
B. 放电时,负极的电极反应为:H2﹣2e﹣+2OH﹣═2H2O
C. 充电时,将电池的碳电极与外电源的正极相连
D. 充电时,阴极的电极反应为:Ni(OH)2+OH﹣﹣e﹣═NiO(OH)+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为使以面粉为原料的面包松软可口,通常用NaHCO3作发泡剂,因为它( )
①热稳定性差 ②增加甜味 ③产生二氧化碳 ④提供钠离子
A. ②③ B. ①③ C. ①④ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 0.1mol SiO2晶体中含有Si-O键的数目为0.2NA
B. 56g铁粉与高温水蒸气反应,生成H2数目为1.5NA
C. 标准状况下,22.4 LCl2溶于水,转移电子数为NA
D. 18gH218O和2H2O的混合物中,所含中子数为9NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水溶液能大量共存的一组离子是( )
A.Na+、Al3+、Cl-、OH-
B.H+、K+、SO42-、CO32-
C.K+、Ba2+、Cl-、NO3-
D.Na+、NH4+、SO42-、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以柏林绿Fe[Fe(CN)6]为代表的新型可充电钠离子电池,其放电工作原理如图所示。下列说法错误的是

A. 放电时,正极反应为Fe[Fe(CN)6]+2Na++2e-=Na2Fe[Fe(CN)6]
B. 充电时,Mo(钼)箔接电源的负极
C. 充电时,Na+通过交换膜从左室移向右室
D. 外电路中通过0.2mol电子的电量时,负极质量变化为2.4g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠晶体(Na2S2O3·5H2O)又称海波,呈无色透明状,易溶于水,不溶于乙醇,常用作棉织物漂白后的脱氯剂、定量分析中的还原剂。
Ⅰ. Na2S2O3·5H2O的制备
Na2S2O3·5H2O的制备方法有多种,其中亚硫酸钠法是工业和实验室中的主要方法:
Na2SO3+S+5H2O![]() Na2S2O3·5H2O
Na2S2O3·5H2O
制备过程如下:
①称取12.6gNa2SO3于100mL烧杯中,加50mL去离子水搅拌溶解。
②另取4.0g硫粉于200mL烧杯中,加6mL乙醇充分搅拌均匀将其润湿,再加入Na2SO3溶液,隔石棉网小火加热煮沸,不断搅拌至硫粉几乎全部反应。
③停止加热,待溶液稍冷却后加2g活性炭,加热煮沸2分钟(脱色)。
④趁热过滤,得滤液至蒸发皿中,_________________、____________________。
⑤过滤、洗涤,用滤纸吸干后,称重,计算产率。
(1)加入的硫粉用乙醇润湿的目的是____________________________。
(2)步骤④趁热过滤的原因_____________________,空格处应采取的操作是_________________、____________________。
(3)步骤⑤洗涤过程中,为防止有部分产品损失,应选用的试剂为__________________________。
(4)滤液中除Na2S2O3 和未反应完全的Na2SO3外,最可能存在的无机杂质是________________,生成该杂质的原因可能是____________________________。
Ⅱ.产品纯度的测定
准确称取1.00g产品(硫代硫酸钠晶体的摩尔质量为248g/mol),用适量蒸馏水溶解,以淀粉作指示剂,用0.1000mol/LI2的标准溶液滴定,反应的离子方程式为:2S2O32-+I2=S4O62-+2I-,记录数据如下:
滴定次数 | 滴定前读数(mL) | 滴定后读数(mL) |
1 | 0.30 | 21.32 |
2 | 0.36 | 22.56 |
3 | 0.10 | 21.08 |
(5)计算所得产品的纯度为___________(保留三位有效数字),该数据的合理解释可能是__________(不考虑实验操作引起的误差)。
Ⅲ.产品的应用
(6)Na2S2O3 常用于脱氯剂,在溶液中易被Cl2 氧化为SO42-,该反应的离子方程式为 _____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com