
【题目】根据晶体中晶胞的结构,判断下列晶体的化学式不正确的是( )
A. AB2  B. C2D
B. C2D C. EF
C. EF  D. XY3Z
D. XY3Z
科目:高中化学 来源: 题型:
【题目】1.28g铜投入一定量的浓硝酸中,铜完全溶解,生成气体颜色越来越浅,共收集到VmL气体(标准状况),将盛有此气体的容器倒扣在水中,通入氧气恰好使气体完全溶解在水中,则需要标准状况下的氧气体积为( )
A. 504mLB. 336mLC. 224mLD. 168mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知在2L的固定容积的密闭容器中进行下列可逆反应,各物质的有关数据如下:
3A (g) + B (g)![]() 2C(g)
2C(g)
起始物质的量浓度(mol/L):1.5 1 0
2s末物质的量浓度(mol/L):0.9 0.8 0.4
则:①0到2s用物质C来表示的反应速率为_________________;
②从反应开始到2s末,B的转化率为________________;
③下列事实不能够说明上述反应在该条件下已经达到化学平衡状态的是_______。
A.气体的平均相对分子质量保持不变
B.容器内气体的密度不变
C.容器内气体的总压强保持不变
D.vA︰vB︰vC=3︰2︰2
E.容器内气体C的物质的量分数保持不变
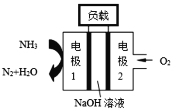
(2)①锌电池有望代替铅蓄电池,它的构成材料是锌、空气、某种电解质溶液,发生的总反应式是:2Zn+O2=2ZnO。则该电池的负极材料是_________;当导线中有0.4 mol电子通过时,理论上消耗的O2在标准状况下的体积是_______ L。
②瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图如右,该燃料电池工作时,外电路中电流方向是从电极_____到电极_____;电池的总反应为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组的同学运用滴定法对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定,请回答下列问题:
(1)用分析天平准确称取该样品5.360g,全部溶于水配制成1000.0mL的溶液。用碱式滴定管取其中20.00mL放在锥形瓶中,滴加几滴甲基橙做指示剂。用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视着____。滴定终点的现象是____________。
(2)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是_____(填写序号)
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,滴定结束时俯视读数
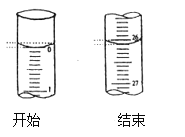
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示:则滴定终点的读数为____mL。
(4)某学生根据三次实验分别记录有关数据如下:
滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol/L盐酸的体积(mL) | ||
滴定前刻度 | 滴定后刻度 | |||
第1次 | 20.00 | 0.00 | 26.01 | |
第2次 | 20.00 | 1.56 | 30.30 | |
第3次 | 20.00 | 0.22 | 26.21 | |
请选用其中合理的数据列式计算出该样品中NaOH的质量百分含量。(写出计算过程)__
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用氯氧化法处理含氰(![]() )废水,一定条件下,氯气和
)废水,一定条件下,氯气和![]() 反应生成无毒气体。下列说法不正确的是
反应生成无毒气体。下列说法不正确的是
A. ![]() 中碳元素的化合价为+2
中碳元素的化合价为+2
B. 该反应的产物之一是无毒的![]()
C. 当1mol![]() 参与反应时,转移
参与反应时,转移![]()
D. 处理含0.1mol![]() 的废水,理论上需要消耗标准状况下
的废水,理论上需要消耗标准状况下![]() 的体积为5.6L
的体积为5.6L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构如图所示,下列说法正确的是
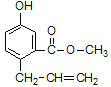
A. 该有机物的分子式为C11H11O3
B. 1 mol该有机物最多能和5 mol H2发生加成反应
C. 该有机物能与碳酸氢钠溶液反应
D. 一定条件下和浓溴水反应时,1 mol 该有机物能消耗3 mol Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象或图象信息不能充分说明相应的化学反应是放热反应的是( )
A | B | C | D | |
反应装置或图象 |
|
|
|
|
实验现象或图象信息 | 温度计的水银柱上升 | 反应物总能量大于生成物总能量 | 反应开始后,针筒活塞向右移动 | 反应开始后,甲处液面低于乙处液面 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钠的主要反应为:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑。
①该反应中的氧化剂是_____,还原剂是____,每生成1molNa2FeO4转移_______mol电子。
②简要说明K2FeO4作为水处理剂时所起的作用:_________。
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、FeO42—、Cl-、H2O。写出并配平湿法制备高铁酸钾的离子反应方程式:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中正确的是( )
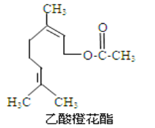
①分子式为C12H20O2 ②能使酸性KMnO4溶液褪色
③可发生取代、加成、消去、但不能发生加聚反应
④它的同分异构体中可能有芳香族化合物
⑤1mol该有机物与溴水发生反应最多消耗3molBr2
⑥1mol该有机物在一定条件下和H2反应,共消耗H2为2mol
A. ①②③B. ①②⑥C. ①②⑤⑥D. ②④⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com