
【题目】某课外活动小组设计的用化学电源使LED灯发光,装置如图。下列说法错误的是![]()
![]()

A.铜片表面有气泡生成
B.装置中存在“化学能→电能→光能”的转换
C.如果将铝片换成银片,电路中的电流方向相反
D.如果将硫酸换成NaOH溶液,LED灯也会发光
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】中国传统文化对人类文明贡献巨大,古代文献中记载了古代化学研究成果。下列常见古诗文对应的化学知识正确的是
常见古诗文记载 | 化学知识 | |
A | 《梦溪笔谈》中对宝剑的记载:“古人以剂钢为刃,柔铁为茎干,不尔则多断折” | 铁的合金硬度比纯铁的大,熔点比纯铁的高 |
B | 《本草纲目拾遗》中对强水的记载:“性最烈,能蚀五金,其水甚强,惟玻璃可盛” | 强水为氢氟酸 |
C | 《天工开物》中记载:凡火药,硫为纯阳,硝为纯阴 | 硫指的是硫黄.硝指的是硝酸钾 |
D | 《泉州府志》中记载:安南人黄姓者为宅煮糖,墙塌压糖,去土而糖白,后人遂效之 | 糖白的过程发生了化学变化 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.28g铜投入一定量的浓硝酸中,铜完全溶解,生成气体颜色越来越浅,共收集到VmL气体(标准状况),将盛有此气体的容器倒扣在水中,通入氧气恰好使气体完全溶解在水中,则需要标准状况下的氧气体积为( )
A. 504mLB. 336mLC. 224mLD. 168mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种降血脂药物吉非罗齐(W)的结构简式为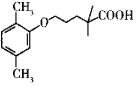 ,一种合成W的路线如下:
,一种合成W的路线如下:
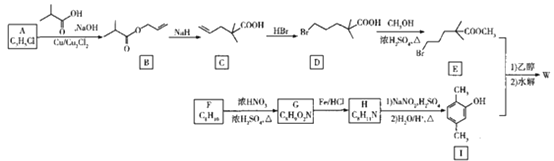
已知:
![]()
回答下列问题:
(1)A的化学名称是______。
(2)C生成D、D生成E的反应类型依次是______、______。
(3)F生成G的化学方程式为______。
(4)H的结构简式为______,W的分子式为______。
(5)X是B的一种同分异构体且所含的官能团完全相同,其核磁共振氢谱有3组峰,面积比为9:2:1,写出一种符合要求的X的结构简式:______。
(6)间苯三酚羧酸( )是一种医药中间体,参照上述合成路线设计以甲苯为起始原料制备间苯三酚羧酸的合成路线:______(无机试剂任用)。
)是一种医药中间体,参照上述合成路线设计以甲苯为起始原料制备间苯三酚羧酸的合成路线:______(无机试剂任用)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可以通过电解NO2制备NH4NO3,其工作原理如图所示,下列说法正确的是
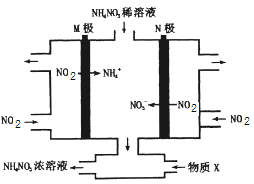
A. 电解过程中,阴极区NO2流入速率比阳极区NO2流入速率快些
B. 阴极区消耗1molNO2需补充6mol化合物X
C. 阳极反应为:NO2+e-+H2O=NO3-+2H+
D. 电解过程中,阴极区的pH小于阳极区的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个不传热的固定容积的密闭容器中,可逆反应mA(g)+nB(s)![]() pC(g)+qD(g),当m、n、p、q为任意整数时,一定说明达到平衡的是( )
pC(g)+qD(g),当m、n、p、q为任意整数时,一定说明达到平衡的是( )
①体系的压强不再改变 ②体系的温度不再改变 ③B的浓度不再改变 ④各组分的质量分数不再改变 ⑤反应速率v(A):v(C):v(D)=m:p:q ⑥单位时间内m mol A发生断键反应,同时p mol C也发生断键反应
A.④⑤⑥B.②④⑥C.①④⑤D.①③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知在2L的固定容积的密闭容器中进行下列可逆反应,各物质的有关数据如下:
3A (g) + B (g)![]() 2C(g)
2C(g)
起始物质的量浓度(mol/L):1.5 1 0
2s末物质的量浓度(mol/L):0.9 0.8 0.4
则:①0到2s用物质C来表示的反应速率为_________________;
②从反应开始到2s末,B的转化率为________________;
③下列事实不能够说明上述反应在该条件下已经达到化学平衡状态的是_______。
A.气体的平均相对分子质量保持不变
B.容器内气体的密度不变
C.容器内气体的总压强保持不变
D.vA︰vB︰vC=3︰2︰2
E.容器内气体C的物质的量分数保持不变
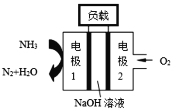
(2)①锌电池有望代替铅蓄电池,它的构成材料是锌、空气、某种电解质溶液,发生的总反应式是:2Zn+O2=2ZnO。则该电池的负极材料是_________;当导线中有0.4 mol电子通过时,理论上消耗的O2在标准状况下的体积是_______ L。
②瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图如右,该燃料电池工作时,外电路中电流方向是从电极_____到电极_____;电池的总反应为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组的同学运用滴定法对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定,请回答下列问题:
(1)用分析天平准确称取该样品5.360g,全部溶于水配制成1000.0mL的溶液。用碱式滴定管取其中20.00mL放在锥形瓶中,滴加几滴甲基橙做指示剂。用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视着____。滴定终点的现象是____________。
(2)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是_____(填写序号)
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示:则滴定终点的读数为____mL。
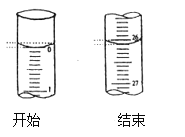
(4)某学生根据三次实验分别记录有关数据如下:
滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol/L盐酸的体积(mL) | ||
滴定前刻度 | 滴定后刻度 | |||
第1次 | 20.00 | 0.00 | 26.01 | |
第2次 | 20.00 | 1.56 | 30.30 | |
第3次 | 20.00 | 0.22 | 26.21 | |
请选用其中合理的数据列式计算出该样品中NaOH的质量百分含量。(写出计算过程)__
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钠的主要反应为:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑。
①该反应中的氧化剂是_____,还原剂是____,每生成1molNa2FeO4转移_______mol电子。
②简要说明K2FeO4作为水处理剂时所起的作用:_________。
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、FeO42—、Cl-、H2O。写出并配平湿法制备高铁酸钾的离子反应方程式:______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com