
【题目】《环境科学》刊发了我国科研部门采用零价铁活化过硫酸钠(Na2S2O8,其中S为+6价)去除废水中的正五价砷[As(V)]的研究成果,其反应机制模型如图所示。Ksp[Fe(OH)3]=2.7×10-39,下列叙述错误的是
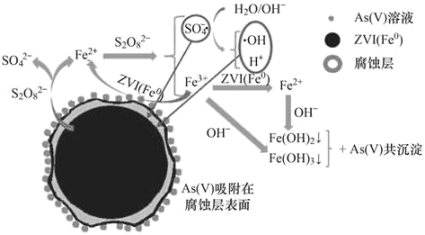
A.pH越小,越有利于去除废水中的正五价砷
B.1mol过硫酸钠(Na2S2O8)含NA个过氧键
C.碱性条件下,硫酸根自由基发生反应的方程式为:SO4-+ OH- = SO42-+OH
D.室温下,中间产物Fe(OH)3溶于水所得饱和溶液中c(Fe3+)约为2.7×10-18mol·L-1
【答案】A
【解析】
A.pH越小,酸性越强,会使Fe(OH)3(s)Fe3+(aq)+3OH-(aq)和Fe(OH)2(s)Fe2+(aq)+2OH-(aq)平衡右移,无法生成沉淀,不利于除去废水中的正五价砷,故A错误;
B.设1mol过硫酸钠(Na2S2O8)中过氧键物质的量为amol,钠为+1价,硫为+6价,过氧键中的氧为-1价,非过氧键中的氧为-2价,则(+1)×2+(+6)×2+(-2) ×a+(-2) ×(8-2a)=0,解得a=1,所以1mol过硫酸钠(Na2S2O8)中过氧键的数量为NA,故B正确;
C.由图示可得,碱性条件下,硫酸根自由基发生反应的方程式为:SO42-+ OH- = SO42-+OH,故C正确;
D.Fe(OH)3溶于水存在沉淀溶解平衡:Fe(OH)3(s)Fe3+(aq)+3OH-(aq),此溶液碱性极弱,pH接近7,即c(OH-)=1×10-7mol/L,因为Ksp(Fe(OH)3)= c(Fe3+)×c3(OH-)=2.7×10-39,则c(Fe3+)=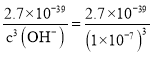 =2.7×10-18mol·L-1,故D正确;
=2.7×10-18mol·L-1,故D正确;
答案选A。


科目:高中化学 来源: 题型:
【题目】胡椒乙酸是合成许多药用生物碱的重要中间体,以苯酚为原料制备胡椒乙酸的合成路线如图所示。

回答下列问题:
(1)下列关于有机物B的说法正确的是 ____________(填字母)。
a.能与FeCl3溶液发生显色反应
b.核磁共振氢谱中只有3组峰
c.能发生银镜反应
d.能与溴水发生加成反应
(2)C的名称是___________,C D的反应类型是_______。
(3)胡椒乙酸(E)中所含官能团的名称为 __________ 。
(4)G生成F的化学方程式为_____________。
(5)W是E的同分异构体,0.5 mol W与足量碳酸氢钠溶液反应生成1 mol C02,已知W的苯环上只有2个取代基,则W的结构共有__________(不含立体异构)种,其中核磁共振氢谱有五组峰的结构简式为_______。
(6)参照上述合成路线,写出以一氯甲苯(![]() )为原料(无机试剂任选)制备苯乙酸的合成路线:____________________
)为原料(无机试剂任选)制备苯乙酸的合成路线:____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物A~H的转换关系如下所示:
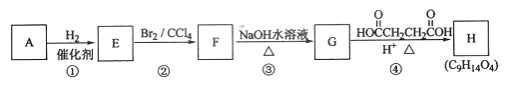
链烃A有支链且只有一个官能团,其相对分子质量在65~75之间,1 mol A完全燃烧消耗7 mol氧气,请回答下列问题:
(1)A的结构简式是________;
(2)由F转化为G的化学方程式是_______________________;
(3)G与金属钠反应能放出气体,由G转化为H的化学方程式是_______________;
(4)①的反应类型是___________;③的反应类型是____________;
(5)链烃B是A的同分异构体,分子中的所有碳原子共平面,其催化氢化产物为正戊烷,写出B任一可能的结构简式_______________________________;
(6)C也是A的一种同分异构体,它的一氯代物只有一种(不考虑立体异构,则C的结构简式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—物质结构与性质】原子序数依次增大的A、B、C、D、E、F六种元素。其中A的基态原子有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的原子序数为29。
(1)F原子基态的外围核外电子排布式为 。
(2)在A、B、C三种元素中,第一电离能由小到大的顺序是 (用元素符号回答)。
(3)元素B的简单气态氢化物的沸点 (高于,低于)元素A的简单气态氢化物的沸点,其主要原因是 。
(4)由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-的结构式为 。
(5)在元素A与E所形成的常见化合物中,A原子轨道的杂化类型为 。
(6)由B、C、D三种元素形成的化合物晶体的晶胞如图所示,则该化合物的化学式为 。
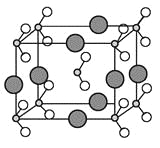
(7)FC在加热条件下容易转化为F2C,从原子结构的角度解释原因 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二次电池锂离子电池广泛应用于手机和电脑等电子产品中。某常见锂离子电池放电时电池的总反应为:Li1-xCoO2+LixC6=LiCoO2+ C6(x<1)。2018年中国回收了全球可回收锂离子电池总量的69%。但现阶段我国废旧电池回收仍属于劳动密集型产业,效率仍需提高。一种回收该锂离子电池中的锂和钴的流程:
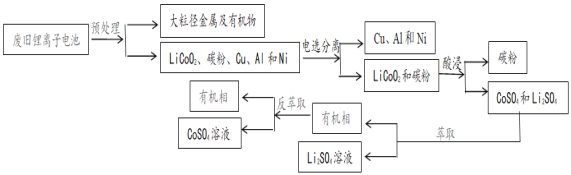
已知:① Na2S2O3是一种中等强度的还原剂,遇强酸分解
② Li2CO3溶解度随温度升高而减小
(1)关于该锂离子电池说法不正确的是_______________________________
A.锂离子电池中无金属锂,充放电过程中,Li+在两个电极之间往返嵌入和脱嵌
B.集中预处理时,为防止短时间内快速放电引起燃烧甚至爆炸,应先进行放电处理
C.充电时若转移0.01mol电子,石墨电极将减重0.07g
D.充电时,阳极的电极反应式为LiCoO2-xe-===Li1-xCoO2+xLi+
(2)LiCoO2是一种具有强氧化性的难溶复合金属氧化物,且Co3+在常温、pH=0.5条件下即开始水解。LiCoO2可溶于硫酸得CoSO4。用硫酸酸浸时,需要加入Na2S2O3作助溶剂,从化学反应原理的角度解释原因:_______________________________,写出浸出CoSO4的离子反应方程式:__________________
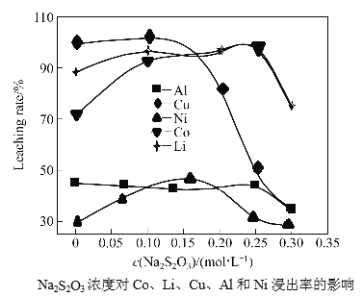
(3)控制氢离子浓度为4mol/L,反应温度90℃,测得相同时间内离子的浸出率与Na2S2O3溶液的变化关系如图。则酸浸时应选用浓度为_______mol/L的Na2S2O3溶液。Na2S2O3溶液浓度增至0.3mol/L时,LiCoO2的浸出率明显下降,可能的原因是_________________(用化学方程式结合文字说明)
(4)整个回收工艺中,可循环使用的物质是_____________________
(5)已知15℃左右Li2CO3的Ksp为3.210-2,该温度下Li2CO3的溶解度约为_____g。将萃取后的Li2SO4溶液加热至95℃,加入饱和Na2CO3溶液,反应10min,________________(填操作)得Li2CO3粉末。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列氧化还原反应中,实际参加反应的氧化剂与还原剂的物质的量之比正确
①KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O;1∶6
②Fe2O3+2Al![]() Al2O3+2Fe;1∶2
Al2O3+2Fe;1∶2
③SiO2+3C![]() SiC(硅为+4价)+2CO↑;1∶2
SiC(硅为+4价)+2CO↑;1∶2
④3NO2+H2O===2HNO3+NO;2∶1
A. ①③ B. ②③ C. ②④ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列卤代烃在KOH醇溶液中加热不发生消去反应的是( )
①![]() ②
②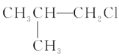 ③(CH3)3CCH2Cl ④CHCl2-CHBr2 ⑤
③(CH3)3CCH2Cl ④CHCl2-CHBr2 ⑤![]() ⑥CH3Cl
⑥CH3Cl
A.①③⑥B.②③⑤C.全部D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素 X、Y、Z、M的原子序数依次增大,它们组成一种团簇分子Z2M2Y4(YX)2,结构如图所示。X、M的族序数均等于周期序数,Y原子核外最外层电子数是其电子总数的![]() ,下列说法正确的是
,下列说法正确的是
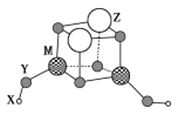
A.简单离子半径: Z>M>Y
B.常温下Z和M的单质均能溶于浓硝酸
C.X与Y结合形成的化合物是离子化合物
D.工业上常用电解Z的氯化物的熔融液来制取Z单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.原子最外层电子数为2的元素一定处于周期表IIA族
B.水分子和氨气分子中,中心原子的杂化方式相同
C.2p能级有两个未成对电子和3p能级有两个未成对电子的原子对应的元素属于同一主族
D.M层全充满而N层为![]() 的原子对应的元素为K
的原子对应的元素为K
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com