
【题目】下列氧化还原反应中,实际参加反应的氧化剂与还原剂的物质的量之比正确
①KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O;1∶6
②Fe2O3+2Al![]() Al2O3+2Fe;1∶2
Al2O3+2Fe;1∶2
③SiO2+3C![]() SiC(硅为+4价)+2CO↑;1∶2
SiC(硅为+4价)+2CO↑;1∶2
④3NO2+H2O===2HNO3+NO;2∶1
A. ①③ B. ②③ C. ②④ D. ①④
【答案】B
【解析】
含元素化合价降低的物质为氧化剂,含元素化合价升高的物质为还原剂,结合反应判断实际参加反应的氧化剂与还原剂的物质的量之比。
①反应KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O中,KClO3为氧化剂,HCl为还原剂,实际参加反应的氧化剂与还原剂的物质的量之比1:5,错误;
②反应Fe2O3+2Al![]() Al2O3+2Fe中,Fe2O3为氧化剂,Al为还原剂,则氧化剂与还原剂的物质的量之比为1:2,正确;
Al2O3+2Fe中,Fe2O3为氧化剂,Al为还原剂,则氧化剂与还原剂的物质的量之比为1:2,正确;
③反应SiO2+3C![]() SiC(硅为+4价)+2CO↑中,碳既是氧化剂,也是还原剂,SiC是还原产物,CO是氧化产物,则氧化剂与还原剂的物质的量之比为1:2,正确;
SiC(硅为+4价)+2CO↑中,碳既是氧化剂,也是还原剂,SiC是还原产物,CO是氧化产物,则氧化剂与还原剂的物质的量之比为1:2,正确;
④反应3NO2+H2O=2HNO3+NO中,只有N元素的化合价变化,1molNO2作氧化剂与2molNO2作还原剂时满足电子守恒,则氧化剂与还原剂的物质的量之比为1:2,错误;
答案选B。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是 ( )
A. FeCl3溶液、Fe(OH)3胶体与Fe(OH)3沉淀的本质区别是有没有丁达尔效应
B. 根据分散系的稳定性大小将混合物分为胶体、溶液和浊液
C. 将几滴汽油加入装有10mL水的试管中,用力振荡形成胶体
D. 胶体、分散系、混合物概念间的从属关系可用图表示

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物电池工作原理如图所示。下列有关说法错误的是

A. 外电路的电流方向是由a到b
B. 正极的电极反应为:O2+4e-+4H+=2H2O
C. 1molC6H12O6完全反应生成CO2,转移24mol电子
D. 反应一段时间后,电池内部的氢离子物质的量减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验表明钠离子聚合物新型电池正负极材料均表现出较快的电极反应动力学,使得电池表现出类似电容器的高功率性能。可以循环充放电高达50000次,这远远超过了传统可充电电池的循环寿命(<10000次)。其放电时的工作原理如图。下列说法不正确的是
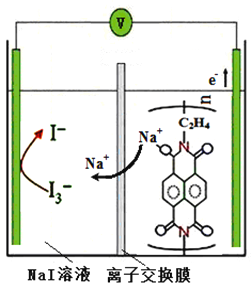
A. 充电时,阳极的电极反应式为3I--2e-=I3-
B. 离子交换膜只能让阳离子通过而不能让阴离子通过
C. 放电时,当转移0.5mol电子时,NaI溶液中增加NA个Na+
D. 放电时,高聚物发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是NaCl、NH4Cl和NaHCO3的溶解度曲线,下列说法不正确的是( )

A. t1℃时,饱和NaCl和NH4Cl溶液的质量分数相同
B. 相同温度下,NaHCO3在水中的溶解度比NaCl和NH4Cl小很多
C. NH4Cl溶解度随温度变化较大
D. t1℃,饱和NaCl和NH4Cl溶液的物质的量浓度相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为三套实验装置。
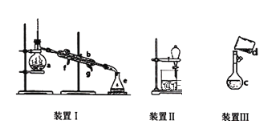
(1)写出下列仪器的名称:a.__________,b._____________。
(2)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器是__________,将仪器补充完整后进行实验,冷凝水由________(填f或g)口通入。
(3)用装置II分离混合物时,为使液体顺利流下,应进行的操作是_______________。
(4)实验室用Na2CO3·10H2O 晶体配制0.05mol/L 的Na2CO3 溶液970mL。
①应用托盘天平称取Na2CO3·10H2O 的质量是____g。
②装置III是某同学转移溶液的示意图。图中的错误是_______________。
③除了图中给出的仪器和托盘天平以及药匙外,为完成实验还需要的仪器有:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸乙酯(C9H10O2)稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等。其制备方法为:
已知:

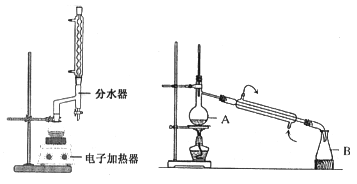
实验步骤如下:①在100 mL圆底烧瓶中加入12.20 g苯甲酸、25mL乙醇(过量)、20mL环己烷,以及4mL浓硫酸,混合均匀并加入沸石,按左上图所示装好仪器,控制温度在65~70℃加热回流2h。反应时环己烷-乙醇-水会形成“共沸物”(沸点62.6℃)蒸馏出来。再利用分水器不断分离除去反应生成的水,回流环己烷和乙醇。
②反应结束,打开旋塞放出分水器中液体后,关闭旋塞。继续加热,至分水器中收集到的液体不再明显增加,停止加热。
③将烧瓶内反应液倒入盛有适量水的烧杯中,分批加入Na2CO3至溶液呈中性。
④用分液漏斗分出有机层,水层用25mL乙醚萃取分液,然后合并有机层。加入氯化钙,对粗产品进行蒸馏(装置如图所示)。低温蒸出乙醚后继续升温,接收210~213℃的馏分。
⑤检验合格,测得产品体积为12.86mL.
(1)步骤①中使用分水器不断分离除去水的目的是_________________。
(2)步骤②中应控制馏分的温度在___________________。
A.65~70℃ B.78~80℃ C.85~90℃ D.215~220℃
(3)步骤③中若Na2CO3加入不足,在步骤④蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是_____________。
(4)步骤④中分液操作叙述正确的是__________。
A.水溶液中加入乙醚,转移至分液漏斗中,塞上玻璃塞。将分液漏斗倒转用力振摇
B.振摇几次后需打开分液漏斗下口的玻璃塞放气
C.经几次振摇并放气后,手持分液漏斗静置待液体分层
D.分液操作时,分液漏斗中的下层液体由下口放出,然后再将上层液体由下口放出
蒸馏装置图中仪器A的名称是___________,在步骤④中加入氯化钙的作用是_________。
(5)该实验产品的产率为____________。
【答案】 有利于平衡不断向正方向移动,提高苯甲酸乙酯产率 C 苯甲酸乙酯中混有苯甲酸,在受热至100℃时发生升华 AB 蒸馏烧瓶 吸水剂 90.02%
【解析】试题分析:本题考查苯甲酸乙酯的制备。
(1)反应![]() +CH3CH2OH
+CH3CH2OH![]()
![]() +H2O为可逆反应,使用分水器不断分离除去水,减小生成物浓度,有利于平衡不断向正反应方向移动,提高苯甲酸乙酯的产率。
+H2O为可逆反应,使用分水器不断分离除去水,减小生成物浓度,有利于平衡不断向正反应方向移动,提高苯甲酸乙酯的产率。
(2)根据题意,反应时环己烷-乙醇-水会形成“共沸物”蒸馏出来。烧瓶内的苯甲酸乙酯中混有乙醇、环己烷、苯甲酸和硫酸,步骤②继续加热蒸出苯甲酸乙酯中的乙醇、环己烷,乙醇的沸点为78.3℃,环己烷的沸点为80.8℃,苯甲酸乙酯的沸点为212.6℃,所以步骤②应控制馏分的温度在85~90℃,答案选C。
(3)步骤③中加入Na2CO3除去苯甲酸乙酯中混有的苯甲酸和硫酸,若Na2CO3加入不足,苯甲酸没有完全除去,步骤④蒸馏时蒸馏烧瓶中可见白烟的原因是:苯甲酸乙酯中混有苯甲酸,苯甲酸在受热至100℃时发生升华。
(4)A,为了使乙醚和水溶液充分接触,水溶液中加入乙醚转移至分液漏斗中后,需塞上玻璃塞,将分液漏斗倒转用力振摇,A项正确;B,为防止分液漏斗中气压过大将玻璃塞弹出,振摇几次后需打开分液漏斗下口的玻璃塞放气,B项正确;C,经几次振摇并放气后,需将分液漏斗置于铁架台上静置、待液体分层,C项错误;D,分液操作时,分液漏斗中的下层液体由下口放出,然后将上层液体从上口倾倒出来,D项错误;答案选AB。蒸馏装置图中仪器A的名称是蒸馏烧瓶。在步骤④中加入CaCl2的作用是作为吸水剂,除去水。
(5)由于乙醇过量,以苯甲酸计算理论生成的苯甲酸乙酯,![]() ~
~![]() ,n(苯甲酸乙酯)理论=n(苯甲酸)=
,n(苯甲酸乙酯)理论=n(苯甲酸)=![]() =0.1mol,m(苯甲酸乙酯)理论=0.1mol
=0.1mol,m(苯甲酸乙酯)理论=0.1mol![]() 150g/mol=15g,该实验产品的产率=
150g/mol=15g,该实验产品的产率=![]() 100%=90.02%。
100%=90.02%。
【题型】实验题
【结束】
19
【题目】根据下列四种元素的第一至第四电离能数据(单位:kJ/mol),回答下面各题:
元素代号 | I1 | I2 | I3 | I4 |
R | 500 | 4600 | 6900 | 9500 |
S | 740 | 1500 | 7700 | 10500 |
T | 580 | 1800 | 2700 | 11600 |
U | 420 | 3100 | 4400 | 5900 |
(1)在周期表中,最可能处于同一族的是___________
A.S和U B.S和T C.T和U D.R和T E.R和U
(2)T的氯化物的化学式为___________________
(3)如果U元素是短周期的元素,你估计它的第2次电离能飞跃数据将是第_____个。
(4)如果R、S、T是同周期的三种主族元素,则它们的原子序数由小到大的顺序是_________,其中元素_______的第一电离能反常高的原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向10 mL 0.1 mol/LCuCl2溶液中滴加0.1 mol/L的Na2S溶液,滴加过程中溶液中lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示,下列有关说法正确的是
已知:lg2=0.3,Ksp(ZnS)=3×10-25 mol2/L2。

A. a、b、c三点中,水的电离程度最大的为b点
B. Na2S溶液中:c(S2-)+c(HS-)+c(H2S)=2c(Na+)
C. 该温度下Ksp(CuS)=4×10-36 mol2/L2
D. 向100 mL Zn2+、Cu2+浓度均为10-5 molL-1的混合溶液中逐滴加入10-4 molL-1的Na2S溶液,Zn2+先沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com