
【题目】下列物质溶于水能导电,但不属于电解质的是( )
A.过氧化钠
B.蔗糖
C.氯气
D.氯化铁
科目:高中化学 来源: 题型:
【题目】下列氧化还原反应中,实际参加反应的氧化剂与还原剂的物质的量之比正确
①KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O;1∶6
②Fe2O3+2Al![]() Al2O3+2Fe;1∶2
Al2O3+2Fe;1∶2
③SiO2+3C![]() SiC(硅为+4价)+2CO↑;1∶2
SiC(硅为+4价)+2CO↑;1∶2
④3NO2+H2O===2HNO3+NO;2∶1
A. ①③ B. ②③ C. ②④ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)暴露在空气中容易爆炸,但利用其作燃料电池是一种理想的电池,具有容量大、能量转化效率高、产物无污染等特点,其工作原理如图所示,下列叙述正确的是
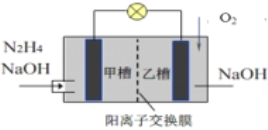
A. 负极反应为4OH-+N2H4 4e– = N2↑+4H2O
B. 当消耗1molO2时,有2mol Na+由甲槽向乙槽迁移
C. 电池工作时,正极附近的pH降低
D. 若去掉离子交换膜电池也能正常工作
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下列装置制备无水AlCl3(183℃升华,過潮湿空气即产生大量白雾)。下列说法正确的是
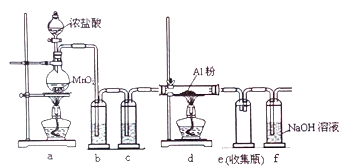
A. 该实验过程中e瓶可能产生白雾
B. b、c装置中分别盛装饱和NaHCO3溶液和浓硫酸
C. 实验开始时应先点燃d处酒精灯,再点燃a处酒精灯
D. 实验后向烧瓶中加入足量硝酸银和确硝酸,可确定生成的MnCl2的质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.氟元素为非金属性最强的元素,氟无正价
B.第ⅠA、ⅡA族元素都具有较强的金属性
C.非金属性:F>Cl>Br>I,则酸性HF>HCl>HBr>HI
D.碱性:NaOH<Mg(OH)2<Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化铈(CeO2)是一种重要的稀土化合物,汽车尾气用稀土/钯三效催化剂处理,不仅可以降低催化剂的成本,还可以提高催化效能。以氟碳铈矿(主要成分为CeCO3F)为原料制备CeO2的一种工艺流程如下:
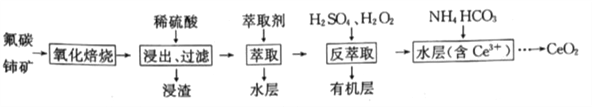
已知i.Ce4+能与F-结合成CeFx(4-x)+,也能与SO42-结合成(CeSO4)2+;
ⅱ.在硫酸体系中Ce4+能被萃取剂[(HA)2]萃取:Ce4++n(HA)2![]() CeH2n-4A2n)+4H+,而Ce3+则不能。
CeH2n-4A2n)+4H+,而Ce3+则不能。
回答下列问题:
(1)CeCO3F中铈元素的化合价为_____,“氧化焙烧”过程中可以加快反应速率的方法是_____(答出两点即可)。
(2)“萃取”时,选用(HA)2作为萃取剂,(HA)2需满足的条件是________;“萃取”后的水层中含有的主要阴离子是________。
(3)“反萃取”时加入H2SO4的作用是__________;加入H2O2的作用是_______(结合离子方程式说明)
(4)浸渣经处理可得Ce(BF4)3,在KCl溶液中加入Ce(BF4)3,发生如下反应:Ce(BF4)3(s)+3K+(aq)![]() 3KBF4(s)+Ce3+(aq)
3KBF4(s)+Ce3+(aq)
一定温度时,Ce(BF4)3、KBF4的Ksp分别为a、b,若上述反应体系中K+的物质的量浓度为cmol/L,则Ce3+的物质的量浓度为______mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用下图装置制备H2S气体,并探究H2S的有关性质。回答下列问题:
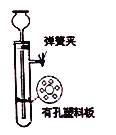
(1)实验开始时,检查装置气密性的方法是_________________。
(2)若装置不漏气,加入装置中的药品为_________(填字母)。
a.FeS和稀硫酸 b.Na2S和稀硫酸 C.ZnS和稀硝酸d.CuS和稀盐酸
该反应的离子方程式为_________________。
(3)打开弹簧夹使反应发生,将生成的H2S气体通入1.0mol/LFe(NO3)3溶液中,观察到有浅黄色固体析出。为探究实际参与该反应的微粒种类,设计如下图装置:

若A装置中加入1.0mol/L的FeCl3溶液,并测其pH=1,则B装置中加入的试剂是______;实验观察到A、B中均有浅黄色固体析出,则H2S与Fe(NO3)3溶液反应的离子方程式为_______。
(4)实验结束时,使反应停止的操作是______;此时反应停止的原因是______________。
(5)常温下,以Na2S为样品,选择合理的仪器和试剂设计实验①证明氢硫酸为二元弱酸②测量并估算氢硫酸的Ka2(H2S),则需要的主要计量仪器为电子天平、容量瓶、_____、_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将12mL0.05mol/LRO32﹣溶液与10mL0.02mol/LX2O72﹣溶液混合恰好完全反应,已知RO32﹣反应后生成RO42﹣ , 则反应后X元素的化合价是( )
A.+6
B.0
C.+3
D.+2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜是一种重要的化工原料,广泛应用于有机合成、石油、油脂、染料等工业。一种利用低品位铜矿(Cu2S、CuS及FeO和Fe2O3等)为原料制取CuCl的工艺流程如下:
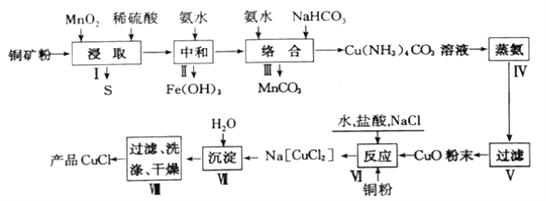
回答下列问题:
(1)步骤Ⅰ“浸取”前需将铜矿粉碎的目的是______;“浸取”时,被氧化的元素有___(填元素符号)。
(2)已知Cu2+、Mn2+、Fe3+开始生成沉淀和沉淀完全的pH如下表,则步骤Ⅱ“中和”时,pH应控制的范围为_______________;
物质 | Cu(OH)2 | Mn(OH)2 | Fe(OH)3 |
开始沉淀pH | 4.7 | 8.3 | 1.2 |
完全沉淀pH | 6.7 | 9.8 | 3.2 |
已知25℃时Ksp(MnCO3)=2.4×10—11、离子浓度为1.0×10-5mol/L时即完全沉淀,步骤Ⅲ中Mn2+完全沉淀时c(CO32—)= ________________。
(3)步骤IV加热“蒸氨”时发生反应的化学方程式为________________。
(4)步骤VI反应的离子方程式为______________,其中盐酸需过量,其原因是________________。
(5)步骤Ⅶ获得CuCl晶体需经过滤、洗涤、干燥。洗涤时,常有无水乙醇代替蒸馏水做洗涤剂的优点是______________(写一点)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com