
【题目】肼(N2H4)暴露在空气中容易爆炸,但利用其作燃料电池是一种理想的电池,具有容量大、能量转化效率高、产物无污染等特点,其工作原理如图所示,下列叙述正确的是
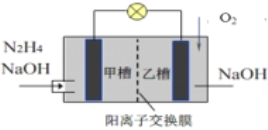
A. 负极反应为4OH-+N2H4 4e– = N2↑+4H2O
B. 当消耗1molO2时,有2mol Na+由甲槽向乙槽迁移
C. 电池工作时,正极附近的pH降低
D. 若去掉离子交换膜电池也能正常工作
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】微生物电池工作原理如图所示。下列有关说法错误的是

A. 外电路的电流方向是由a到b
B. 正极的电极反应为:O2+4e-+4H+=2H2O
C. 1molC6H12O6完全反应生成CO2,转移24mol电子
D. 反应一段时间后,电池内部的氢离子物质的量减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸乙酯(C9H10O2)稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等。其制备方法为:
已知:

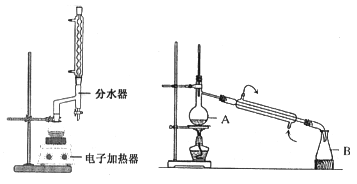
实验步骤如下:①在100 mL圆底烧瓶中加入12.20 g苯甲酸、25mL乙醇(过量)、20mL环己烷,以及4mL浓硫酸,混合均匀并加入沸石,按左上图所示装好仪器,控制温度在65~70℃加热回流2h。反应时环己烷-乙醇-水会形成“共沸物”(沸点62.6℃)蒸馏出来。再利用分水器不断分离除去反应生成的水,回流环己烷和乙醇。
②反应结束,打开旋塞放出分水器中液体后,关闭旋塞。继续加热,至分水器中收集到的液体不再明显增加,停止加热。
③将烧瓶内反应液倒入盛有适量水的烧杯中,分批加入Na2CO3至溶液呈中性。
④用分液漏斗分出有机层,水层用25mL乙醚萃取分液,然后合并有机层。加入氯化钙,对粗产品进行蒸馏(装置如图所示)。低温蒸出乙醚后继续升温,接收210~213℃的馏分。
⑤检验合格,测得产品体积为12.86mL.
(1)步骤①中使用分水器不断分离除去水的目的是_________________。
(2)步骤②中应控制馏分的温度在___________________。
A.65~70℃ B.78~80℃ C.85~90℃ D.215~220℃
(3)步骤③中若Na2CO3加入不足,在步骤④蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是_____________。
(4)步骤④中分液操作叙述正确的是__________。
A.水溶液中加入乙醚,转移至分液漏斗中,塞上玻璃塞。将分液漏斗倒转用力振摇
B.振摇几次后需打开分液漏斗下口的玻璃塞放气
C.经几次振摇并放气后,手持分液漏斗静置待液体分层
D.分液操作时,分液漏斗中的下层液体由下口放出,然后再将上层液体由下口放出
蒸馏装置图中仪器A的名称是___________,在步骤④中加入氯化钙的作用是_________。
(5)该实验产品的产率为____________。
【答案】 有利于平衡不断向正方向移动,提高苯甲酸乙酯产率 C 苯甲酸乙酯中混有苯甲酸,在受热至100℃时发生升华 AB 蒸馏烧瓶 吸水剂 90.02%
【解析】试题分析:本题考查苯甲酸乙酯的制备。
(1)反应![]() +CH3CH2OH
+CH3CH2OH![]()
![]() +H2O为可逆反应,使用分水器不断分离除去水,减小生成物浓度,有利于平衡不断向正反应方向移动,提高苯甲酸乙酯的产率。
+H2O为可逆反应,使用分水器不断分离除去水,减小生成物浓度,有利于平衡不断向正反应方向移动,提高苯甲酸乙酯的产率。
(2)根据题意,反应时环己烷-乙醇-水会形成“共沸物”蒸馏出来。烧瓶内的苯甲酸乙酯中混有乙醇、环己烷、苯甲酸和硫酸,步骤②继续加热蒸出苯甲酸乙酯中的乙醇、环己烷,乙醇的沸点为78.3℃,环己烷的沸点为80.8℃,苯甲酸乙酯的沸点为212.6℃,所以步骤②应控制馏分的温度在85~90℃,答案选C。
(3)步骤③中加入Na2CO3除去苯甲酸乙酯中混有的苯甲酸和硫酸,若Na2CO3加入不足,苯甲酸没有完全除去,步骤④蒸馏时蒸馏烧瓶中可见白烟的原因是:苯甲酸乙酯中混有苯甲酸,苯甲酸在受热至100℃时发生升华。
(4)A,为了使乙醚和水溶液充分接触,水溶液中加入乙醚转移至分液漏斗中后,需塞上玻璃塞,将分液漏斗倒转用力振摇,A项正确;B,为防止分液漏斗中气压过大将玻璃塞弹出,振摇几次后需打开分液漏斗下口的玻璃塞放气,B项正确;C,经几次振摇并放气后,需将分液漏斗置于铁架台上静置、待液体分层,C项错误;D,分液操作时,分液漏斗中的下层液体由下口放出,然后将上层液体从上口倾倒出来,D项错误;答案选AB。蒸馏装置图中仪器A的名称是蒸馏烧瓶。在步骤④中加入CaCl2的作用是作为吸水剂,除去水。
(5)由于乙醇过量,以苯甲酸计算理论生成的苯甲酸乙酯,![]() ~
~![]() ,n(苯甲酸乙酯)理论=n(苯甲酸)=
,n(苯甲酸乙酯)理论=n(苯甲酸)=![]() =0.1mol,m(苯甲酸乙酯)理论=0.1mol
=0.1mol,m(苯甲酸乙酯)理论=0.1mol![]() 150g/mol=15g,该实验产品的产率=
150g/mol=15g,该实验产品的产率=![]() 100%=90.02%。
100%=90.02%。
【题型】实验题
【结束】
19
【题目】根据下列四种元素的第一至第四电离能数据(单位:kJ/mol),回答下面各题:
元素代号 | I1 | I2 | I3 | I4 |
R | 500 | 4600 | 6900 | 9500 |
S | 740 | 1500 | 7700 | 10500 |
T | 580 | 1800 | 2700 | 11600 |
U | 420 | 3100 | 4400 | 5900 |
(1)在周期表中,最可能处于同一族的是___________
A.S和U B.S和T C.T和U D.R和T E.R和U
(2)T的氯化物的化学式为___________________
(3)如果U元素是短周期的元素,你估计它的第2次电离能飞跃数据将是第_____个。
(4)如果R、S、T是同周期的三种主族元素,则它们的原子序数由小到大的顺序是_________,其中元素_______的第一电离能反常高的原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向10 mL 0.1 mol/LCuCl2溶液中滴加0.1 mol/L的Na2S溶液,滴加过程中溶液中lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示,下列有关说法正确的是
已知:lg2=0.3,Ksp(ZnS)=3×10-25 mol2/L2。

A. a、b、c三点中,水的电离程度最大的为b点
B. Na2S溶液中:c(S2-)+c(HS-)+c(H2S)=2c(Na+)
C. 该温度下Ksp(CuS)=4×10-36 mol2/L2
D. 向100 mL Zn2+、Cu2+浓度均为10-5 molL-1的混合溶液中逐滴加入10-4 molL-1的Na2S溶液,Zn2+先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作与实验目的或结论一致的是
选项 | 实验操作 | 实验目的或结论 |
A | 向0.1mol·L-1 Na2SO4溶液中滴加BaCl2溶液至不再产生沉淀,再滴加0.1mol/L Na2CO3无现象 | 证明Ksp(BaSO4)<Ksp(BaCO3) |
B | 向盛有KI3溶液的两试管中分别滴加淀粉溶液、AgNO3溶液,前者变蓝色,后者有黄色沉淀 | 证明KI3溶液中存在:I3- |
C | 向NaA1O2溶液中持续通入气体,先产生白色沉淀,后沉淀完全溶解 | 该气体可能是CO2 |
D | 在Fe(NO3)2溶液中滴加硫酸酸化的双氧水溶液,溶液变黄色 | 证明氧化性:H2O2>Fe3+ |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今年入冬以来,我市大部分地区雾霾严重,严重影响人们的日常生活.“改善环境条件,提高空气质量:人人有责!下列措施对控制雾霾无影响的是( )
A.机动车限号行驶,鼓励乘公交出行
B.不焚烧农作物秸秆
C.局部地区实行人工降雨、降雪
D.家庭安装空气净化器
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Be(OH)2是两性的,跟强酸反应时生成Be2+,跟强碱反应时生成BeO22—。现有三份等物质的量浓度、等体积的BeCl2、MgCl2、AlCl3溶液(配制时均加入少量盐酸),现将一定浓度的NaOH溶液分别滴入三种溶液中至过量,NaOH溶液的体积x(mL)与生成沉淀的物质的量y(mol)的关系如图所示,则与BeCl2、MgCl2、AlCl3三种溶液对应的图像正确的是( )

A. ⑤③① B. ②③④ C. ③⑤④ D. ③②①
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com