
【题目】微生物电池工作原理如图所示。下列有关说法错误的是

A. 外电路的电流方向是由a到b
B. 正极的电极反应为:O2+4e-+4H+=2H2O
C. 1molC6H12O6完全反应生成CO2,转移24mol电子
D. 反应一段时间后,电池内部的氢离子物质的量减少
科目:高中化学 来源: 题型:
【题目】已知:乙二酸晶体熔点101.5℃;乙二酸晶体加热分解的方程式为:H2C2O42H2O![]() 3H2O + CO2↑+ CO↑。现利用下列装置验证反应产物中含有CO2和CO(装置不能重复使用)。请回答下列问题:
3H2O + CO2↑+ CO↑。现利用下列装置验证反应产物中含有CO2和CO(装置不能重复使用)。请回答下列问题:

(1)检验装置A气密性的方法是________________________________________________
(2)A装置是否有误_____________(填“是”或“否”),原因为_______________________
(3)按气流方向连接各仪器,用数字表示接口的连接顺序:①→_________________________;
(4)该套装置有明显缺陷,请予以更正________________________________________________
(5)证明CO存在的实验现象是_________________________________________________;
(6)根据题给的数据,假设反应产生的气体全部排出,并与吸收液充分反应(提示:B、C中澄清石灰水均先变浑浊,后又变澄清),最终D中生成了两种物质,则这两种生成物的化学式及对应的物质的量分别是①_______________,②_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T1℃时,在四个容积均为1L的恒容密闭容器中发生反应:2NO(g)+2H2(g)![]() N2(g)+2H2O(g) ΔH,该反应的速率表达式为v=k·cm(NO)·cn(H2)(k、m、n为常数),测得有关实验数据如下:
N2(g)+2H2O(g) ΔH,该反应的速率表达式为v=k·cm(NO)·cn(H2)(k、m、n为常数),测得有关实验数据如下:
容器编号 | 物质的起始浓度 (mol/L) | 速率 (mol·L-1·s-1) | 物质的平衡浓度 (mol/L) | |
c(NO) | c(H2) | c(N2) | ||
Ⅰ | 6×10-3 | 1×10-3 | a×10-3 | 2×10-4 |
Ⅱ | 6×10-3 | 2×10-3 | 2a×10-3 | |
Ⅲ | 1×10-3 | 6×10-3 | b×10-3 | |
Ⅳ | 2×10-3 | 6×10-3 | 4b×10-3 | |
下列说法正确的是
A. m=2,n=1
B. 达到平衡时,容器Ⅱ与容器Ⅳ的总压强之比为1:2
C. 温度升高为T2℃,测得平衡时,容器Ⅱ中c(H2O)=3.8×10-4mol/L,则ΔH>0
D. T1℃时,容器Ⅲ中达到平衡后再充入NO、H2O(g)各2×10-4mol,则反应将向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到目的是
A. 用PH试纸测定次氯酸溶液的pH
B. 将FeCl3溶液加热蒸干并灼烧获得Fe2O3固体
C. 向明矾溶液中加入一定量NaOH,制备Al(OH)3胶体
D. 室温下,测得pH=5的NaHSO4溶液与pH=9的NaHCO3溶液中水的电离程度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2Cr2O7是一种重要的化工原料。以铬铁矿(主要成分为FeO·Cr2O3,还含有Al2O3、Fe2O3等杂质)为原料制备K2Cr2O7的一种工艺流程如下:

已知:
①4FeO·Cr2O3+8Na2CO3+7O2 ![]() 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
②Cr2O72-+H2O![]() 2CrO42-+2H+
2CrO42-+2H+
(1)“焙烧”时,Al2O3与Na2CO3发生反应的化学方程式为___________。
(2)“滤渣”的主要成分是________(填化学式).
(3)“酸化”步骤调节溶液pH<5,其目的是_________
(4)“转化”一步发生反应的化学方程式为____________
(5)采用电解法处理含铬废水原理如下图所示。阳极区溶液中发生反应:Cr2O72-+6Fe2++14H+ == 2Cr3+ +6Fe3+ + 7H2O,阳极的电极反应式为_______,阴极产生的气体为_______(填化学式)。
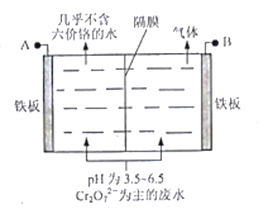
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素,主要以碘化物形式存在。有一化学课外小组用海带为原料制取少量碘单质,他们将海带灼烧成灰,用水浸泡一段时间(让碘化物充分溶解在水中),得到海带灰悬浊液,然后按以下实验流程提取单质碘:

(1)指出提取碘的过程中有关的实验操作名称:①_________③_________
(2)操作③中所用的有机试剂可以是CCl4,简述选择理由_________________________________。
(3)操作过程③包括如下几步:
A.检验分液漏斗活塞和上口的玻璃塞是否漏液; B.把盛有溶液的分液漏斗放在铁架台的铁圈中; C.把50 mL碘水和15 mL有机溶剂(你所选的)加入分液漏斗中,并盖好玻璃塞; D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正; E.静置、分层; F.将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准; G.旋开活塞,用烧杯接收溶液; H.从分液漏斗上口倒出上层液体。
a.上述F步操作的目的是:_____________________________
b.最后碘的CCl4溶液是通过_____________________获得(填“漏斗上口”或“漏斗下口”)。
(4)从含碘的有机溶液中提取碘和回收有机溶液CCl4,还需要经过蒸馏,观察下图所示实验装置,指出仪器名称b__________,冷却水从____进入(填A或B),最后碘留在_________________里。(填仪器名称)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列氧化还原反应中,实际参加反应的氧化剂与还原剂的物质的量之比正确
①KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O;1∶6
②Fe2O3+2Al![]() Al2O3+2Fe;1∶2
Al2O3+2Fe;1∶2
③SiO2+3C![]() SiC(硅为+4价)+2CO↑;1∶2
SiC(硅为+4价)+2CO↑;1∶2
④3NO2+H2O===2HNO3+NO;2∶1
A. ①③ B. ②③ C. ②④ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)暴露在空气中容易爆炸,但利用其作燃料电池是一种理想的电池,具有容量大、能量转化效率高、产物无污染等特点,其工作原理如图所示,下列叙述正确的是
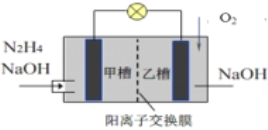
A. 负极反应为4OH-+N2H4 4e– = N2↑+4H2O
B. 当消耗1molO2时,有2mol Na+由甲槽向乙槽迁移
C. 电池工作时,正极附近的pH降低
D. 若去掉离子交换膜电池也能正常工作
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com