
【题目】温度为T1℃时,在四个容积均为1L的恒容密闭容器中发生反应:2NO(g)+2H2(g)![]() N2(g)+2H2O(g) ΔH,该反应的速率表达式为v=k·cm(NO)·cn(H2)(k、m、n为常数),测得有关实验数据如下:
N2(g)+2H2O(g) ΔH,该反应的速率表达式为v=k·cm(NO)·cn(H2)(k、m、n为常数),测得有关实验数据如下:
容器编号 | 物质的起始浓度 (mol/L) | 速率 (mol·L-1·s-1) | 物质的平衡浓度 (mol/L) | |
c(NO) | c(H2) | c(N2) | ||
Ⅰ | 6×10-3 | 1×10-3 | a×10-3 | 2×10-4 |
Ⅱ | 6×10-3 | 2×10-3 | 2a×10-3 | |
Ⅲ | 1×10-3 | 6×10-3 | b×10-3 | |
Ⅳ | 2×10-3 | 6×10-3 | 4b×10-3 | |
下列说法正确的是
A. m=2,n=1
B. 达到平衡时,容器Ⅱ与容器Ⅳ的总压强之比为1:2
C. 温度升高为T2℃,测得平衡时,容器Ⅱ中c(H2O)=3.8×10-4mol/L,则ΔH>0
D. T1℃时,容器Ⅲ中达到平衡后再充入NO、H2O(g)各2×10-4mol,则反应将向逆反应方向进行
【答案】AD
【解析】反应Ⅰ、Ⅱ相比较,NO的浓度不变,Ⅱ中氢气浓度是Ⅰ的2倍,反应速率Ⅱ是Ⅰ的2倍,所以n=1;反应Ⅲ、Ⅳ相比较,氢气的浓度不变,Ⅳ中NO浓度是Ⅲ的2倍,反应速率Ⅳ是Ⅲ的4倍,所以m=2;选项A正确。恒温恒容下,体系的压强比等于气体的物质的量的比,对于反应Ⅱ有:
2NO(g) + 2H2(g) ![]() N2(g) + 2H2O(g)
N2(g) + 2H2O(g)
起始: 6 2 0 0
反应: x x x/2 x/2
平衡: 6-x 2-x x/2 x/2
对于反应Ⅲ有:
2NO(g) + 2H2(g) ![]() N2(g) + 2H2O(g)
N2(g) + 2H2O(g)
起始: 2 6 0 0
反应: y y y/2 y/2
平衡: 2-y 6-y y/2 y/2 (以上单位都是10-3mol/L)
两个反应的平衡常数必然相等,列出其平衡常数计算式,两个反应的K值相等,一定得到x=y。则得到达平衡时两个反应体系的气体总物质的量相等,所以压强相等,选项B错误。温度不变的前提下,从反应Ⅰ变为反应Ⅱ,氢气的浓度变为原来的2倍,则平衡正向移动,达到新平衡的时候c(N2)应该大于2×10-4mol/L,此时的c(H2O)应该大于4×10-4mol/L;但是,实际升高温度以后实验Ⅱ达平衡时c(H2O)= 3.8×10-4mol/L<4×10-4mol/L,说明升高温度的时候,平衡一定逆向移动了,所以该反应为放热反应,焓变小于0,选项C错误。增大生成物浓度,平衡一定逆向移动,所以充入NO、H2O(g)各2×10-4mol,则反应将向逆反应方向进行,选项D正确。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列有关叙述正确的是( )
A. 乙烯和丙烯组成的42g混合气体中碳氢键数目为6NA
B. 标准状兄下,22.4L二氯甲烷的分子数约为NA
C. 常温常压下,1mol甲醇完全燃烧生成CO2和H2O,转移的电子数目为12NA
D. 将1molCH3COONa溶于稀醋酸中使溶液呈中性,溶液中CH3COO-数目小于NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是 ( )
A. FeCl3溶液、Fe(OH)3胶体与Fe(OH)3沉淀的本质区别是有没有丁达尔效应
B. 根据分散系的稳定性大小将混合物分为胶体、溶液和浊液
C. 将几滴汽油加入装有10mL水的试管中,用力振荡形成胶体
D. 胶体、分散系、混合物概念间的从属关系可用图表示

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】每年进入冬季,我国许多城市就会出现雾霾天气。下列做法能减轻雾霾形成的是( )
A. 市郊露天焚烧秸秆 B. 推广使用燃煤发电
C. 大量使用机动车辆 D. 多利用太阳能发电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关化学方程式:NH3+CO2+H2O===NH4HCO3NH4HCO3+NaCl===NaHCO3↓+NH4Cl、2NaHCO3![]() Na2CO3+CO2↑+H2O。
Na2CO3+CO2↑+H2O。
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是(____)
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们设计了各种方案。
A同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。试回答下列有关问题:


①乙装置中的试剂是____________;
②丁装置中稀硫酸的作用是______________________;
③实验结束后,分离出NaHCO3晶体的操作是________(填分离操作的名称)。
B同学用图中戊装置(其他装置未画出)进行实验:
② 实验时,须先从________管通入________ 气体,再从________管中通入________气体;
②有同学建议在戊装置的b管下端连接己装置,理由是_____________________________。
(3)请你再写出一种实验室制取少量碳酸氢钠的方法:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式错误的是
A. H2S通入CuSO4溶液中:H2S+Cu2+==CuS↓+2H+
B. AlCl3溶液与Na2S溶液混合生成沉淀::2 Al3++3S2-==Al2S3↓
C. 用惰性电极电解BaCl2溶液:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
D. 用TiCl4制备TiO2的第一步反应:Ti4++ (x+2) H2O(过量)![]() TiO2·xH2O↓+ 4H+
TiO2·xH2O↓+ 4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物电池工作原理如图所示。下列有关说法错误的是

A. 外电路的电流方向是由a到b
B. 正极的电极反应为:O2+4e-+4H+=2H2O
C. 1molC6H12O6完全反应生成CO2,转移24mol电子
D. 反应一段时间后,电池内部的氢离子物质的量减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验表明钠离子聚合物新型电池正负极材料均表现出较快的电极反应动力学,使得电池表现出类似电容器的高功率性能。可以循环充放电高达50000次,这远远超过了传统可充电电池的循环寿命(<10000次)。其放电时的工作原理如图。下列说法不正确的是
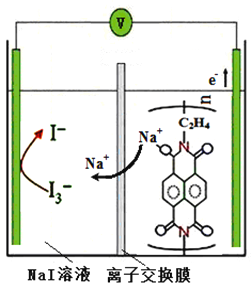
A. 充电时,阳极的电极反应式为3I--2e-=I3-
B. 离子交换膜只能让阳离子通过而不能让阴离子通过
C. 放电时,当转移0.5mol电子时,NaI溶液中增加NA个Na+
D. 放电时,高聚物发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向10 mL 0.1 mol/LCuCl2溶液中滴加0.1 mol/L的Na2S溶液,滴加过程中溶液中lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示,下列有关说法正确的是
已知:lg2=0.3,Ksp(ZnS)=3×10-25 mol2/L2。

A. a、b、c三点中,水的电离程度最大的为b点
B. Na2S溶液中:c(S2-)+c(HS-)+c(H2S)=2c(Na+)
C. 该温度下Ksp(CuS)=4×10-36 mol2/L2
D. 向100 mL Zn2+、Cu2+浓度均为10-5 molL-1的混合溶液中逐滴加入10-4 molL-1的Na2S溶液,Zn2+先沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com