
【题目】苯甲酸乙酯(C9H10O2)稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等。其制备方法为:
已知:

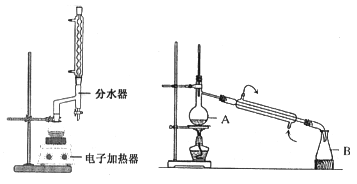
实验步骤如下:①在100 mL圆底烧瓶中加入12.20 g苯甲酸、25mL乙醇(过量)、20mL环己烷,以及4mL浓硫酸,混合均匀并加入沸石,按左上图所示装好仪器,控制温度在65~70℃加热回流2h。反应时环己烷-乙醇-水会形成“共沸物”(沸点62.6℃)蒸馏出来。再利用分水器不断分离除去反应生成的水,回流环己烷和乙醇。
②反应结束,打开旋塞放出分水器中液体后,关闭旋塞。继续加热,至分水器中收集到的液体不再明显增加,停止加热。
③将烧瓶内反应液倒入盛有适量水的烧杯中,分批加入Na2CO3至溶液呈中性。
④用分液漏斗分出有机层,水层用25mL乙醚萃取分液,然后合并有机层。加入氯化钙,对粗产品进行蒸馏(装置如图所示)。低温蒸出乙醚后继续升温,接收210~213℃的馏分。
⑤检验合格,测得产品体积为12.86mL.
(1)步骤①中使用分水器不断分离除去水的目的是_________________。
(2)步骤②中应控制馏分的温度在___________________。
A.65~70℃ B.78~80℃ C.85~90℃ D.215~220℃
(3)步骤③中若Na2CO3加入不足,在步骤④蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是_____________。
(4)步骤④中分液操作叙述正确的是__________。
A.水溶液中加入乙醚,转移至分液漏斗中,塞上玻璃塞。将分液漏斗倒转用力振摇
B.振摇几次后需打开分液漏斗下口的玻璃塞放气
C.经几次振摇并放气后,手持分液漏斗静置待液体分层
D.分液操作时,分液漏斗中的下层液体由下口放出,然后再将上层液体由下口放出
蒸馏装置图中仪器A的名称是___________,在步骤④中加入氯化钙的作用是_________。
(5)该实验产品的产率为____________。
【答案】 有利于平衡不断向正方向移动,提高苯甲酸乙酯产率 C 苯甲酸乙酯中混有苯甲酸,在受热至100℃时发生升华 AB 蒸馏烧瓶 吸水剂 90.02%
【解析】试题分析:本题考查苯甲酸乙酯的制备。
(1)反应![]() +CH3CH2OH
+CH3CH2OH![]()
![]() +H2O为可逆反应,使用分水器不断分离除去水,减小生成物浓度,有利于平衡不断向正反应方向移动,提高苯甲酸乙酯的产率。
+H2O为可逆反应,使用分水器不断分离除去水,减小生成物浓度,有利于平衡不断向正反应方向移动,提高苯甲酸乙酯的产率。
(2)根据题意,反应时环己烷-乙醇-水会形成“共沸物”蒸馏出来。烧瓶内的苯甲酸乙酯中混有乙醇、环己烷、苯甲酸和硫酸,步骤②继续加热蒸出苯甲酸乙酯中的乙醇、环己烷,乙醇的沸点为78.3℃,环己烷的沸点为80.8℃,苯甲酸乙酯的沸点为212.6℃,所以步骤②应控制馏分的温度在85~90℃,答案选C。
(3)步骤③中加入Na2CO3除去苯甲酸乙酯中混有的苯甲酸和硫酸,若Na2CO3加入不足,苯甲酸没有完全除去,步骤④蒸馏时蒸馏烧瓶中可见白烟的原因是:苯甲酸乙酯中混有苯甲酸,苯甲酸在受热至100℃时发生升华。
(4)A,为了使乙醚和水溶液充分接触,水溶液中加入乙醚转移至分液漏斗中后,需塞上玻璃塞,将分液漏斗倒转用力振摇,A项正确;B,为防止分液漏斗中气压过大将玻璃塞弹出,振摇几次后需打开分液漏斗下口的玻璃塞放气,B项正确;C,经几次振摇并放气后,需将分液漏斗置于铁架台上静置、待液体分层,C项错误;D,分液操作时,分液漏斗中的下层液体由下口放出,然后将上层液体从上口倾倒出来,D项错误;答案选AB。蒸馏装置图中仪器A的名称是蒸馏烧瓶。在步骤④中加入CaCl2的作用是作为吸水剂,除去水。
(5)由于乙醇过量,以苯甲酸计算理论生成的苯甲酸乙酯,![]() ~
~![]() ,n(苯甲酸乙酯)理论=n(苯甲酸)=
,n(苯甲酸乙酯)理论=n(苯甲酸)=![]() =0.1mol,m(苯甲酸乙酯)理论=0.1mol
=0.1mol,m(苯甲酸乙酯)理论=0.1mol![]() 150g/mol=15g,该实验产品的产率=
150g/mol=15g,该实验产品的产率=![]() 100%=90.02%。
100%=90.02%。
【题型】实验题
【结束】
19
【题目】根据下列四种元素的第一至第四电离能数据(单位:kJ/mol),回答下面各题:
元素代号 | I1 | I2 | I3 | I4 |
R | 500 | 4600 | 6900 | 9500 |
S | 740 | 1500 | 7700 | 10500 |
T | 580 | 1800 | 2700 | 11600 |
U | 420 | 3100 | 4400 | 5900 |
(1)在周期表中,最可能处于同一族的是___________
A.S和U B.S和T C.T和U D.R和T E.R和U
(2)T的氯化物的化学式为___________________
(3)如果U元素是短周期的元素,你估计它的第2次电离能飞跃数据将是第_____个。
(4)如果R、S、T是同周期的三种主族元素,则它们的原子序数由小到大的顺序是_________,其中元素_______的第一电离能反常高的原因是_____________。
【答案】 E TCl3 10 R<S<T S S元素的最外层电子处于s能级全满,能量较低,比较稳定,失去一个电子吸收的能量较多
【解析】试题分析:本题考查电离能的分析和电离能的应用。R的各级电离能:I1![]() I2
I2![]() I3
I3![]() I4,R的第二电离能远大于第一电离能,R原子的最外层有1个电子;S的各级电离能:I1
I4,R的第二电离能远大于第一电离能,R原子的最外层有1个电子;S的各级电离能:I1![]() I2
I2![]() I3
I3![]() I4,S的第三电离能远大于第二电离能,S原子的最外层有2个电子;T的各级电离能:I1
I4,S的第三电离能远大于第二电离能,S原子的最外层有2个电子;T的各级电离能:I1![]() I2
I2![]() I3
I3![]() I4,T的第四电离能远大于第三电离能,T原子的最外层有3个电子;U的各级电离能:I1
I4,T的第四电离能远大于第三电离能,T原子的最外层有3个电子;U的各级电离能:I1![]() I2
I2![]() I3
I3![]() I4,U的第二电离能远大于第一电离能,U原子的最外层有1个电子。
I4,U的第二电离能远大于第一电离能,U原子的最外层有1个电子。
(1)根据上述分析,R原子和U原子的最外层有1个电子,最可能都处于IA族,最可能处于同一族的是R和U,答案选E。
(2)T原子的最外层有3个电子,T的化合价为+3价,T的氯化物的化学式为TCl3。
(3)根据上述分析,U的第1次电离能飞跃是失去第2个电子,U是短周期元素,估计U的第2次电离能飞跃是失去第10个电子时发生。
(4)若R、S、T是同周期的三种主族元素,R的最外层电子数为1,R位于第IA族,S的最外层电子数为2,S位于第IIA族,T的最外层电子数为3,T位于IIIA族,它们的原子序数由小到大的顺序为R![]() S
S![]() T。其中元素S的第一电离能反常的高,原因是:S的价电子排布式为ns2,S元素的最外层的s能级为全充满,能量较低,比较稳定,失去一个电子吸收的能量较多。
T。其中元素S的第一电离能反常的高,原因是:S的价电子排布式为ns2,S元素的最外层的s能级为全充满,能量较低,比较稳定,失去一个电子吸收的能量较多。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知:乙二酸晶体熔点101.5℃;乙二酸晶体加热分解的方程式为:H2C2O42H2O![]() 3H2O + CO2↑+ CO↑。现利用下列装置验证反应产物中含有CO2和CO(装置不能重复使用)。请回答下列问题:
3H2O + CO2↑+ CO↑。现利用下列装置验证反应产物中含有CO2和CO(装置不能重复使用)。请回答下列问题:

(1)检验装置A气密性的方法是________________________________________________
(2)A装置是否有误_____________(填“是”或“否”),原因为_______________________
(3)按气流方向连接各仪器,用数字表示接口的连接顺序:①→_________________________;
(4)该套装置有明显缺陷,请予以更正________________________________________________
(5)证明CO存在的实验现象是_________________________________________________;
(6)根据题给的数据,假设反应产生的气体全部排出,并与吸收液充分反应(提示:B、C中澄清石灰水均先变浑浊,后又变澄清),最终D中生成了两种物质,则这两种生成物的化学式及对应的物质的量分别是①_______________,②_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素,主要以碘化物形式存在。有一化学课外小组用海带为原料制取少量碘单质,他们将海带灼烧成灰,用水浸泡一段时间(让碘化物充分溶解在水中),得到海带灰悬浊液,然后按以下实验流程提取单质碘:

(1)指出提取碘的过程中有关的实验操作名称:①_________③_________
(2)操作③中所用的有机试剂可以是CCl4,简述选择理由_________________________________。
(3)操作过程③包括如下几步:
A.检验分液漏斗活塞和上口的玻璃塞是否漏液; B.把盛有溶液的分液漏斗放在铁架台的铁圈中; C.把50 mL碘水和15 mL有机溶剂(你所选的)加入分液漏斗中,并盖好玻璃塞; D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正; E.静置、分层; F.将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准; G.旋开活塞,用烧杯接收溶液; H.从分液漏斗上口倒出上层液体。
a.上述F步操作的目的是:_____________________________
b.最后碘的CCl4溶液是通过_____________________获得(填“漏斗上口”或“漏斗下口”)。
(4)从含碘的有机溶液中提取碘和回收有机溶液CCl4,还需要经过蒸馏,观察下图所示实验装置,指出仪器名称b__________,冷却水从____进入(填A或B),最后碘留在_________________里。(填仪器名称)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列氧化还原反应中,实际参加反应的氧化剂与还原剂的物质的量之比正确
①KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O;1∶6
②Fe2O3+2Al![]() Al2O3+2Fe;1∶2
Al2O3+2Fe;1∶2
③SiO2+3C![]() SiC(硅为+4价)+2CO↑;1∶2
SiC(硅为+4价)+2CO↑;1∶2
④3NO2+H2O===2HNO3+NO;2∶1
A. ①③ B. ②③ C. ②④ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基羧酸盐在工业、农业、生活中都有着十分广泛的应用。氨基甲酸铵(NH2COONH4)可用做肥料、灭火剂、洗涤剂等,甘氨酸亚铁[(NH2CH2COO)2Fe]可用作补铁剂等。
已知:i. 氨基甲酸铵:白色固体,易分解,易水解;甘氨酸亚铁:易溶于水,难溶于乙醇。
ii. 甘氨酸:易溶于水,微溶于乙醇,两性化合物。
iii. 柠檬酸:易溶于水和乙醇,有较强酸性和还原性。
实验室制备方法如下:
I.制备氨基甲酸铵:反应的化学方程式为:2NH3(g)+CO2(g) ![]() NH2COONH4(g) △H<0
NH2COONH4(g) △H<0
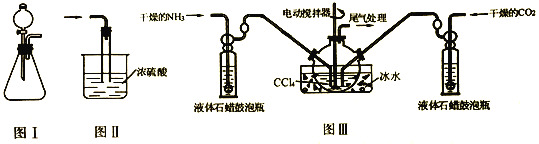
(1)图Ⅰ装置制备NH3,则所选试剂为_________________
(2)图Ⅲ装置制备氨基甲酸铵,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。(注:四氯化碳与液体石蜡均为惰性介质。)
①从反应后的混合物中分离出产品的实验操作是_______________(填操作名称)
②图Ⅱ装置进行尾气处理,则双通玻璃管的作用________________
③液体石蜡鼓泡瓶的作用是________________
④发生器用冰水冷却的原因是________________
II.制备(NH2CH2COO)2Fe:装置如图(夹持和加热仪器已省略), 用CO2气体将装置中空气排净,加入药品后,滴入柠檬酸并加热。反应结束后过滤,将滤液蒸发浓缩,加入乙醇,过滤、干燥得到产品。
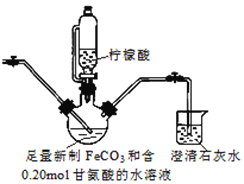
(3)烧杯中澄清石灰水的作用是_______________。
(4)柠檬酸可调节pH,体系pH与产率的关系如下表:
实验 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
体系pH | 4.0 | 4.5 | 5.0 | 5.5 | 6.0 | 6.5 | 7.0 | 7.5 |
产率/% | 65.74 | 74.96 | 78.78 | 83.13 | 85.57 | 72.98 | 62.31 | 56.68 |
分析pH过低使产率下降的原因是___________;柠檬酸的作用还有_____(填序号)。
a.作反应终点指示剂 b.防止二价铁被氧化 c. 作催化剂 d. 促进FeCO3溶解
(5)乙醇的作用是________________。
(6)若产品的质量为m g,则产率为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法中正确的是( )
①12C和14C的化学性质相同 ②37Cl原子核内中子数为17
③12CO2与14CO2互为同位素 ④Ca和Ca2+是同种元素,且性质相同
A.①③B.②③C.①D.④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
①离子化合物一定含离子键,也可能含极性键或非极性键②共价化合物一定含共价键,也可能含离子键③含金属元素的化合物不一定是离子化合物④由非金属元素组成的化合物一定是共价化合物
A.①②B.②④C.②③④D.①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)暴露在空气中容易爆炸,但利用其作燃料电池是一种理想的电池,具有容量大、能量转化效率高、产物无污染等特点,其工作原理如图所示,下列叙述正确的是
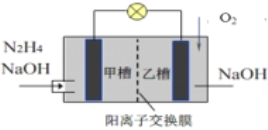
A. 负极反应为4OH-+N2H4 4e– = N2↑+4H2O
B. 当消耗1molO2时,有2mol Na+由甲槽向乙槽迁移
C. 电池工作时,正极附近的pH降低
D. 若去掉离子交换膜电池也能正常工作
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用下图装置制备H2S气体,并探究H2S的有关性质。回答下列问题:
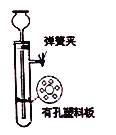
(1)实验开始时,检查装置气密性的方法是_________________。
(2)若装置不漏气,加入装置中的药品为_________(填字母)。
a.FeS和稀硫酸 b.Na2S和稀硫酸 C.ZnS和稀硝酸d.CuS和稀盐酸
该反应的离子方程式为_________________。
(3)打开弹簧夹使反应发生,将生成的H2S气体通入1.0mol/LFe(NO3)3溶液中,观察到有浅黄色固体析出。为探究实际参与该反应的微粒种类,设计如下图装置:

若A装置中加入1.0mol/L的FeCl3溶液,并测其pH=1,则B装置中加入的试剂是______;实验观察到A、B中均有浅黄色固体析出,则H2S与Fe(NO3)3溶液反应的离子方程式为_______。
(4)实验结束时,使反应停止的操作是______;此时反应停止的原因是______________。
(5)常温下,以Na2S为样品,选择合理的仪器和试剂设计实验①证明氢硫酸为二元弱酸②测量并估算氢硫酸的Ka2(H2S),则需要的主要计量仪器为电子天平、容量瓶、_____、_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com