
【题目】将氢氧化钠溶液滴入某氯化镁和氯化铝的混合溶液中,则下列图象变化趋势正确的( )
A. 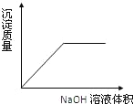 B.
B. 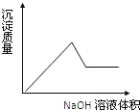
C. 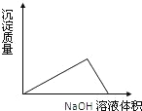 D.
D. 
【答案】B
【解析】
氯化镁和氢氧化钠生成氯化钠和氢氧化镁沉淀;氯化铝和氢氧化钠生成氯化钠和氢氧化铝沉淀,所以刚开始沉淀逐渐增大,氢氧化铝和过量的氢氧化钠生成偏铝酸钠和水,所以当氢氧化钠过量时,沉淀会溶解一部分,然后分析图象并对照即可。
氯化镁和氢氧化钠生成氯化钠和氢氧化镁沉淀;氯化铝和氢氧化钠生成氯化钠和氢氧化铝沉淀,所以刚开始随着氢氧化钠的加入,沉淀逐渐增大,故D错误,氢氧化铝和过量的氢氧化钠生成偏铝酸钠和水,所以当氢氧化钠过量时,沉淀会溶解一部分,在图象中就是沉淀的质量会下降,故A错误,但是氢氧化镁是不溶于氢氧化钠的,所以最后是一条平行于横坐标的直线(氢氧化镁沉淀的质量保持不变),故C错误,只有B符合,
所以B选项是正确的。


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素,主要以碘化物形式存在。有一化学课外小组用海带为原料制取少量碘单质,他们将海带灼烧成灰,用水浸泡一段时间(让碘化物充分溶解在水中),得到海带灰悬浊液,然后按以下实验流程提取单质碘:

(1)指出提取碘的过程中有关的实验操作名称:①_________③_________
(2)操作③中所用的有机试剂可以是CCl4,简述选择理由_________________________________。
(3)操作过程③包括如下几步:
A.检验分液漏斗活塞和上口的玻璃塞是否漏液; B.把盛有溶液的分液漏斗放在铁架台的铁圈中; C.把50 mL碘水和15 mL有机溶剂(你所选的)加入分液漏斗中,并盖好玻璃塞; D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正; E.静置、分层; F.将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准; G.旋开活塞,用烧杯接收溶液; H.从分液漏斗上口倒出上层液体。
a.上述F步操作的目的是:_____________________________
b.最后碘的CCl4溶液是通过_____________________获得(填“漏斗上口”或“漏斗下口”)。
(4)从含碘的有机溶液中提取碘和回收有机溶液CCl4,还需要经过蒸馏,观察下图所示实验装置,指出仪器名称b__________,冷却水从____进入(填A或B),最后碘留在_________________里。(填仪器名称)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
①离子化合物一定含离子键,也可能含极性键或非极性键②共价化合物一定含共价键,也可能含离子键③含金属元素的化合物不一定是离子化合物④由非金属元素组成的化合物一定是共价化合物
A.①②B.②④C.②③④D.①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)暴露在空气中容易爆炸,但利用其作燃料电池是一种理想的电池,具有容量大、能量转化效率高、产物无污染等特点,其工作原理如图所示,下列叙述正确的是
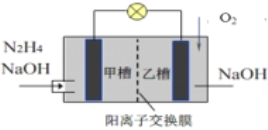
A. 负极反应为4OH-+N2H4 4e– = N2↑+4H2O
B. 当消耗1molO2时,有2mol Na+由甲槽向乙槽迁移
C. 电池工作时,正极附近的pH降低
D. 若去掉离子交换膜电池也能正常工作
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于晶体的下列说法正确的是
A. 任何晶体中,若含有阳离子就一定有阴离子
B. 原子晶体中只含有共价键
C. 原子晶体的熔点一定比金属晶体的高
D. 离子晶体中只含有离子键,不含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下列装置制备无水AlCl3(183℃升华,過潮湿空气即产生大量白雾)。下列说法正确的是
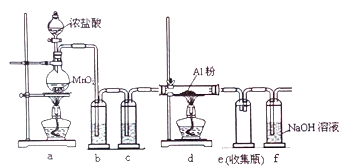
A. 该实验过程中e瓶可能产生白雾
B. b、c装置中分别盛装饱和NaHCO3溶液和浓硫酸
C. 实验开始时应先点燃d处酒精灯,再点燃a处酒精灯
D. 实验后向烧瓶中加入足量硝酸银和确硝酸,可确定生成的MnCl2的质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.氟元素为非金属性最强的元素,氟无正价
B.第ⅠA、ⅡA族元素都具有较强的金属性
C.非金属性:F>Cl>Br>I,则酸性HF>HCl>HBr>HI
D.碱性:NaOH<Mg(OH)2<Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用下图装置制备H2S气体,并探究H2S的有关性质。回答下列问题:
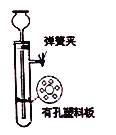
(1)实验开始时,检查装置气密性的方法是_________________。
(2)若装置不漏气,加入装置中的药品为_________(填字母)。
a.FeS和稀硫酸 b.Na2S和稀硫酸 C.ZnS和稀硝酸d.CuS和稀盐酸
该反应的离子方程式为_________________。
(3)打开弹簧夹使反应发生,将生成的H2S气体通入1.0mol/LFe(NO3)3溶液中,观察到有浅黄色固体析出。为探究实际参与该反应的微粒种类,设计如下图装置:

若A装置中加入1.0mol/L的FeCl3溶液,并测其pH=1,则B装置中加入的试剂是______;实验观察到A、B中均有浅黄色固体析出,则H2S与Fe(NO3)3溶液反应的离子方程式为_______。
(4)实验结束时,使反应停止的操作是______;此时反应停止的原因是______________。
(5)常温下,以Na2S为样品,选择合理的仪器和试剂设计实验①证明氢硫酸为二元弱酸②测量并估算氢硫酸的Ka2(H2S),则需要的主要计量仪器为电子天平、容量瓶、_____、_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸是重要的化工原料,在工业上可用于制造化肥、农药、炸药和染料等。下列关于浓硝酸性质的描述不正确的是
A.难挥发B.能溶于水C.能与碳反应D.能与氨气反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com