
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为三套实验装置。
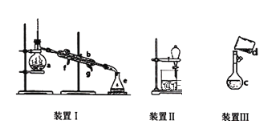
(1)写出下列仪器的名称:a.__________,b._____________。
(2)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器是__________,将仪器补充完整后进行实验,冷凝水由________(填f或g)口通入。
(3)用装置II分离混合物时,为使液体顺利流下,应进行的操作是_______________。
(4)实验室用Na2CO3·10H2O 晶体配制0.05mol/L 的Na2CO3 溶液970mL。
①应用托盘天平称取Na2CO3·10H2O 的质量是____g。
②装置III是某同学转移溶液的示意图。图中的错误是_______________。
③除了图中给出的仪器和托盘天平以及药匙外,为完成实验还需要的仪器有:_______________。
【答案】蒸馏烧瓶 冷凝管 酒精灯 g 打开分液漏斗上口的玻璃塞(或使塞上的凹槽或小孔对准漏斗上的小孔) 14.3 未用玻璃棒引流 玻璃棒、胶头滴管、量筒
【解析】
根据蒸馏和分液原理、以及配制物质的量浓度溶液的方法,分析回答问题。
(1)装置I为蒸馏装置,仪器a为蒸馏烧瓶,b为冷凝管。
(2)利用装置I分离四氯化碳和酒精,还缺少的仪器是酒精灯。进行实验时冷凝水由g口通入,与被冷凝的蒸气方向相反,可提高冷凝效果。
(3)装置II用于分离互不相溶的液体混合物。为使液体顺利流下,应打开分液漏斗上口的玻璃塞,或使塞上的凹槽(或小孔)对准漏斗上的小孔,使分液漏斗内外气体相通,压强相等。
(4)实验室用Na2CO3·10H2O 晶体配制0.05mol/L 的Na2CO3 溶液970mL。
①应选1000mL容量瓶,称取Na2CO3·10H2O的质量为1L×0.05mol/L×286g/mol=14.3g。
②向容量瓶转移溶液时必须用玻璃棒引流,装置III未用玻璃棒引流。
③称量时要托盘天平、药匙,溶解时要量筒、烧杯、玻璃棒,后面还需要容量瓶、胶头滴管等。故还需要量筒、玻璃棒、胶头滴管。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响,在室温下按照如下方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10mL2% H2O2溶液 | 无 |
② | 10mL5% H2O2溶液 | 无 |
③ | 10mL5% H2O2溶液 | 1mL0.1mol/LlFeCl3溶液 |
④ | 10mL5% H2O2溶液+少量HCI溶液 | 1mL0.1mol/LlFeCl3溶液 |
⑤ | 10mL5%H2O2溶液+少量NaOH溶液 | 1mL0.1mol/LlFeCl3溶液 |
(1)催化剂能加快化学反应速率的原因是__________________________。
(2)实验①和②的目的是_________________________。实验时由于较长时间没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进________________________。
(3)写出实验③的化学反应方程式___________________________________。
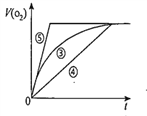
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图。分析上图能够得出的实验结论是__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2Cr2O7是一种重要的化工原料。以铬铁矿(主要成分为FeO·Cr2O3,还含有Al2O3、Fe2O3等杂质)为原料制备K2Cr2O7的一种工艺流程如下:

已知:
①4FeO·Cr2O3+8Na2CO3+7O2 ![]() 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
②Cr2O72-+H2O![]() 2CrO42-+2H+
2CrO42-+2H+
(1)“焙烧”时,Al2O3与Na2CO3发生反应的化学方程式为___________。
(2)“滤渣”的主要成分是________(填化学式).
(3)“酸化”步骤调节溶液pH<5,其目的是_________
(4)“转化”一步发生反应的化学方程式为____________
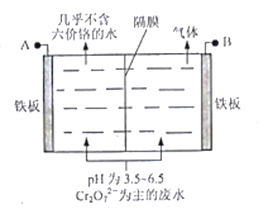
(5)采用电解法处理含铬废水原理如下图所示。阳极区溶液中发生反应:Cr2O72-+6Fe2++14H+ == 2Cr3+ +6Fe3+ + 7H2O,阳极的电极反应式为_______,阴极产生的气体为_______(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中全属于有机物的是__________;全属于烃的是__________。
A.CH4、C2H5OH、C6H12O6(果糖)、(C6H10O5)n(淀粉)
B.C2H2、H2O2、CCl4、C6H6
C.CH4、C2H4、H2CO3、CH3Cl
D.CH4、C2H6、C2H2、C6H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列氧化还原反应中,实际参加反应的氧化剂与还原剂的物质的量之比正确
①KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O;1∶6
②Fe2O3+2Al![]() Al2O3+2Fe;1∶2
Al2O3+2Fe;1∶2
③SiO2+3C![]() SiC(硅为+4价)+2CO↑;1∶2
SiC(硅为+4价)+2CO↑;1∶2
④3NO2+H2O===2HNO3+NO;2∶1
A. ①③ B. ②③ C. ②④ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
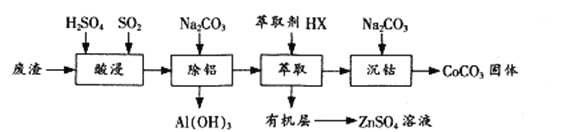
【题目】过渡金属催化的反应已成为重要的合成工具,贵金属成本高,会对环境造成的不利影响。因此研究成本低廉的含锰、铁、钴、镍、铜等催化剂应用成为热点。以下是以含钴废渣(主要成分CoO、Co2O3,还含有Al2O3、ZnO等杂质)为原料制备CoCO3的一种工艺流程:
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol/L计算)
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Co2+ | 7.6 | 9.4 |
Al3+ | 3.0 | 5.0 |
Zn2+ | 5.4 | 8.0 |
回答下列问题:
(1)“酸浸”时通入SO2的目的是 ____________,反应的离子方程式为______________。
(2)“萃取”过程可表示为ZnSO4(水层)+2HX(有机层)![]() ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是 __________________。
ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是 __________________。
(3)“沉钴”时Na2CO3溶液需缓慢滴加的原因是 ____________。
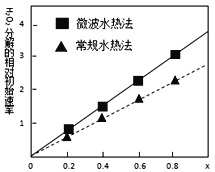
(4)用得到的CoCO3等为原料采用微波水热法和常规水热法可以制得两种CoxNi(1-x)Fe2O4(其中Co、Ni均为+2价),均可用作H2O2分解的催化剂,有较高的活性。如图是两种不同方法制得的CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化曲线。由图中信息可知:____________法制取得到的催化剂活性更高,由此推测Co2+、Ni2+两种离子中催化效果更好的是____________ 。
(5)用纯碱沉淀转化法也可以从草酸钴(CoC2O4)废料得到CoCO3,向含有CoC2O4固体的溶液中滴加Na2CO3溶液,当有CoCO3沉淀生成时,溶液中![]() =___________。[已知Ksp(CoC2O4)=6.3×10-8 Ksp (CoCO3)=1.4×10- 13]
=___________。[已知Ksp(CoC2O4)=6.3×10-8 Ksp (CoCO3)=1.4×10- 13]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法中正确的是( )
①12C和14C的化学性质相同 ②37Cl原子核内中子数为17
③12CO2与14CO2互为同位素 ④Ca和Ca2+是同种元素,且性质相同
A.①③B.②③C.①D.④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化钛(TiCl4)是生产金属钛及其化合物的重要中间体。室温下,四氯化钛为无色液体。某化学兴趣小组同学以TiO2和CCl4为原料在实验室制取液态TiCl4,装置如图所示。
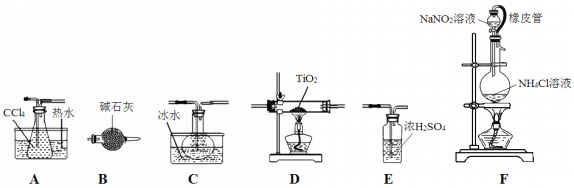
有关信息如下:
①反应原理:TiO2(s)+CCl4(g) △ T iCl4(g)+CO2(g)。
②反应条件:无水无氧且加热。
③有关物质性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 其它 |
CCl4 | 23 | 76 | 与TiCl4互溶 |
TiCl4 | 25 | 136 | 遇潮湿空气产生白雾 |
请回答下列问题:
(1)装置F橡皮管的作用是_________________________________________,装置F中有氮气生成,该反应的化学方程式为__________________________________________。
(2)实验装置依次连接的顺序为F→B→_____→_____→_____→_____。________________
(3)欲分离C中的液态混合物,所采用操作的名称是_____________。
(4)实验开始前首先点燃____处酒精灯(填“D或F”),目的是___________________。
(5)E装置______(填“能或不能”)换成B装置,理由是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化铈(CeO2)是一种重要的稀土化合物,汽车尾气用稀土/钯三效催化剂处理,不仅可以降低催化剂的成本,还可以提高催化效能。以氟碳铈矿(主要成分为CeCO3F)为原料制备CeO2的一种工艺流程如下:
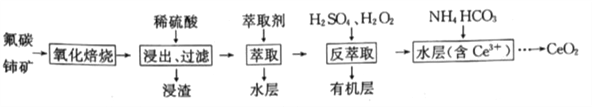
已知i.Ce4+能与F-结合成CeFx(4-x)+,也能与SO42-结合成(CeSO4)2+;
ⅱ.在硫酸体系中Ce4+能被萃取剂[(HA)2]萃取:Ce4++n(HA)2![]() CeH2n-4A2n)+4H+,而Ce3+则不能。
CeH2n-4A2n)+4H+,而Ce3+则不能。
回答下列问题:
(1)CeCO3F中铈元素的化合价为_____,“氧化焙烧”过程中可以加快反应速率的方法是_____(答出两点即可)。
(2)“萃取”时,选用(HA)2作为萃取剂,(HA)2需满足的条件是________;“萃取”后的水层中含有的主要阴离子是________。
(3)“反萃取”时加入H2SO4的作用是__________;加入H2O2的作用是_______(结合离子方程式说明)
(4)浸渣经处理可得Ce(BF4)3,在KCl溶液中加入Ce(BF4)3,发生如下反应:Ce(BF4)3(s)+3K+(aq)![]() 3KBF4(s)+Ce3+(aq)
3KBF4(s)+Ce3+(aq)
一定温度时,Ce(BF4)3、KBF4的Ksp分别为a、b,若上述反应体系中K+的物质的量浓度为cmol/L,则Ce3+的物质的量浓度为______mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com