
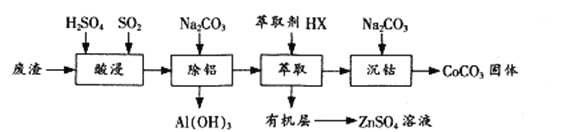
【题目】过渡金属催化的反应已成为重要的合成工具,贵金属成本高,会对环境造成的不利影响。因此研究成本低廉的含锰、铁、钴、镍、铜等催化剂应用成为热点。以下是以含钴废渣(主要成分CoO、Co2O3,还含有Al2O3、ZnO等杂质)为原料制备CoCO3的一种工艺流程:
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol/L计算)
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Co2+ | 7.6 | 9.4 |
Al3+ | 3.0 | 5.0 |
Zn2+ | 5.4 | 8.0 |
回答下列问题:
(1)“酸浸”时通入SO2的目的是 ____________,反应的离子方程式为______________。
(2)“萃取”过程可表示为ZnSO4(水层)+2HX(有机层)![]() ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是 __________________。
ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是 __________________。
(3)“沉钴”时Na2CO3溶液需缓慢滴加的原因是 ____________。
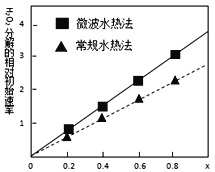
(4)用得到的CoCO3等为原料采用微波水热法和常规水热法可以制得两种CoxNi(1-x)Fe2O4(其中Co、Ni均为+2价),均可用作H2O2分解的催化剂,有较高的活性。如图是两种不同方法制得的CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化曲线。由图中信息可知:____________法制取得到的催化剂活性更高,由此推测Co2+、Ni2+两种离子中催化效果更好的是____________ 。
(5)用纯碱沉淀转化法也可以从草酸钴(CoC2O4)废料得到CoCO3,向含有CoC2O4固体的溶液中滴加Na2CO3溶液,当有CoCO3沉淀生成时,溶液中![]() =___________。[已知Ksp(CoC2O4)=6.3×10-8 Ksp (CoCO3)=1.4×10- 13]
=___________。[已知Ksp(CoC2O4)=6.3×10-8 Ksp (CoCO3)=1.4×10- 13]
【答案】 将Co3+转化为Co2+ 2Co3++SO2+2H2O= 2Co2++SO42-+4H+ 向有几层中加入适量的硫酸溶液充分振荡,静置,分液 防止加入过快而产生Co(OH)2沉淀 微波水热 Co2+ 2.2×10-6
【解析】(1)从流程图知要把Co3+转化为Co2+,SO2具有还原性,能把Co3+转化为Co2+,所以“酸浸”时通入SO2的目的是将Co3+转化为Co2+ ,反应的离子方程式为2Co3++SO2+2H2O= 2Co2++SO42-+4H+。因此,本题正确答案为:将Co3+转化为Co2+。
(2)“萃取”过程可表示为ZnSO4(水层)+2HX(有机层)![]() ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是向有几层中加入适量的硫酸溶液,使平衡逆向进行,充分振荡后再静置,分液。
ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是向有几层中加入适量的硫酸溶液,使平衡逆向进行,充分振荡后再静置,分液。
(3)为防止因加入Na2CO3溶液过快而产生Co(OH)2沉淀,“沉钴”时需缓慢滴加,因此,本题正确答案为:防止加入过快而产生Co(OH)2沉淀。
(4)H2O2分解的分解速率越大,催化剂活性活性越高,根据图像可以知道,X相同时,微波水热法初始速率大于常规水热法,故微波水热制取得到的催化剂活性更高;由图可以知道,随X越大,过氧化氢的分解速率越大,而X增大,Co2+的比例增大,故Co2+的催化效果更好,因此,本题正确答案为:微波水热 ;Co2+。
(5)向含有CoC2O4固体的溶液中滴加Na2CO3溶液,当有CoCO3沉淀生成时,Ksp(CoC2O4)=c(Co2+)![]() c(CO32-),Ksp (CoCO3)=c(Co2+)
c(CO32-),Ksp (CoCO3)=c(Co2+)![]() c(C2O42-),所以溶液中
c(C2O42-),所以溶液中![]() = Ksp (CoCO3)/ Ksp(CoC2O4)= 1.4×10- 13/6.3×10-8=2.2×10-6。
= Ksp (CoCO3)/ Ksp(CoC2O4)= 1.4×10- 13/6.3×10-8=2.2×10-6。


科目:高中化学 来源: 题型:
【题目】关于常温下pH=3的HF溶液,下列叙述正确的是
A. c(H+)=c(F-)
B. 加水稀释时,c(F-)/c(HF)增大
C. 与pH=11的NaOH溶液等体积混合后,溶液呈碱性
D. 加入NaF固体可以抑制HF的电离,使溶液中c(F-)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自来水中氯离子的测定对人体健康有重要意义,实验室常用莫尔法测定水体中氯离子含量。实验过程如下:向水样中加入K2CrO4 (黄色) 溶液作指示剂,用AgNO3溶液滴定至终点。已知:Ag2CrO4为不溶于水的砖红色沉淀;常温下Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)= 1.8×10-12。
回答下列问题:
(1)滴定时,应使用____________(填“酸式”或“碱式”) 滴定管,原因是_______________________。
(2)水样应调至中性或弱碱性,强酸性时加入K2CrO4溶液发生反应的离子方程式是___________________________________________。
(3)滴定达到终点的标志是___________________________________________。
(4)实验过程中测得数据如下表:
编号 | 1 | 2 | 3 |
V(水样)/mL | 10.00 | 10.00 | 10.00 |
c(AgNO3)/ mol·L-1 | 0.0010 | ||
V(AgNO3)/mL | 3.75 | 4.01 | 3.99 |
计算水样中氯离子的含量为_______________mg/L(保留2位小数)
(5)滴定结束后:
①当溶液中的残余c(Cl-)=1.8×10-5mol/L,则此时溶液中c(CrO42-)=____________。
②已知2AgCl+ CrO42-![]() 2Cl-+Ag2CrO4,计算出该反应的平衡常数为____________。
2Cl-+Ag2CrO4,计算出该反应的平衡常数为____________。
(6)下列情况会造成实验测定结果偏低的是____________。(填标号)
A.锥形瓶洗涤后未干燥
B.滴定前,未使用标准液润洗滴定管
C.酸式滴定管滴定前仰视读数,滴定后俯视读数
D.酸式滴定管滴定前尖嘴部分充满溶液,滴定结束时滴定管尖嘴有气泡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. NO2、SO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足了8e-稳定结构;
B. P4和CH4都是正四面体分子且键角都为109o28ˊ;
C. CO2、SO2都是直线形的分子
D. CH2=CH2分子中共有五个σ键和一个π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为三套实验装置。
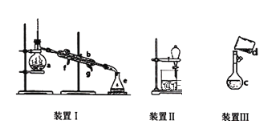
(1)写出下列仪器的名称:a.__________,b._____________。
(2)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器是__________,将仪器补充完整后进行实验,冷凝水由________(填f或g)口通入。
(3)用装置II分离混合物时,为使液体顺利流下,应进行的操作是_______________。
(4)实验室用Na2CO3·10H2O 晶体配制0.05mol/L 的Na2CO3 溶液970mL。
①应用托盘天平称取Na2CO3·10H2O 的质量是____g。
②装置III是某同学转移溶液的示意图。图中的错误是_______________。
③除了图中给出的仪器和托盘天平以及药匙外,为完成实验还需要的仪器有:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 28g CO所占的体积为22.4L
B. 1L 1mol/L HCl溶液中含有HCl分子为NA个
C. 标准状况下,2.24L水中约含有NA个氧原子
D. 标准状况下22.4LCO和CO2的混合气体中含碳原子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.12mol FeCl2加入100ml K2Cr2O7溶液中,恰好使溶液中Fe2+全部转化为Fe3+,Cr2O72﹣被还原为Cr3+。则K2Cr2O7溶液的物质的量浓度为
A. 0.4mol/L B. 0.1mol/L C. 0.2mol/L D. 0.08mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】早在西汉时期就有记载“曾青得铁则化为铜”,成为现代湿法冶金的先驱,要加快该化学反应的速率,所采取的下列措施无效的是( )
A.增大硫酸铜的浓度B.提高反应的温度
C.增大压强D.用铁粉代替铁片
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com