
ΓΨΧβΡΩΓΩΉ‘ά¥Υ°÷–¬»άκΉ”ΒΡ≤βΕ®Ε‘»ΥΧεΫΓΩΒ”–÷Ί“Σ“β“εΘ§ Β―ι “≥Θ”ΟΡΣΕϊΖ®≤βΕ®Υ°Χε÷–¬»άκΉ”Κ§ΝΩΓΘ Β―ιΙΐ≥Χ»γœ¬ΘΚœρΥ°―υ÷–Φ”»κK2CrO4 (ΜΤ…Ϊ) »ή“ΚΉς÷Η ΨΦΝΘ§”ΟAgNO3»ή“ΚΒΈΕ®÷Ν÷’ΒψΓΘ“―÷ΣΘΚAg2CrO4ΈΣ≤Μ»ή”ΎΥ°ΒΡΉ©Κλ…Ϊ≥ΝΒμΘΜ≥ΘΈ¬œ¬Ksp(AgCl)=1.8ΓΝ10-10Θ§Ksp(Ag2CrO4)= 1.8ΓΝ10-12ΓΘ
ΜΊ¥πœ¬Ν–Έ ΧβΘΚ
Θ®1Θ©ΒΈΕ® ±Θ§”Π Ι”Ο____________(ΧνΓΑΥα ΫΓ±ΜρΓΑΦν ΫΓ±) ΒΈΕ®ΙήΘ§‘≠“ρ «_______________________ΓΘ
Θ®2Θ©Υ°―υ”ΠΒς÷Ν÷––‘Μρ»θΦν–‘Θ§«ΩΥα–‘ ±Φ”»κK2CrO4»ή“ΚΖΔ…ζΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ Ϋ «___________________________________________ΓΘ
Θ®3Θ©ΒΈΕ®¥οΒΫ÷’ΒψΒΡ±ξ÷Ψ «___________________________________________ΓΘ
Θ®4Θ© Β―ιΙΐ≥Χ÷–≤βΒΟ ΐΨί»γœ¬±μΘΚ
±ύΚ≈ | 1 | 2 | 3 |
V(Υ°―υ)/mL | 10.00 | 10.00 | 10.00 |
c(AgNO3)/ molΓΛL-1 | 0.0010 | ||
V(AgNO3)/mL | 3.75 | 4.01 | 3.99 |
ΦΤΥψΥ°―υ÷–¬»άκΉ”ΒΡΚ§ΝΩΈΣ_______________mg/LΘ®±ΘΝτ2ΈΜ–Γ ΐΘ©
Θ®5Θ©ΒΈΕ®Ϋα χΚσΘΚ
ΔΌΒ±»ή“Κ÷–ΒΡ≤–”ύc(Cl-)=1.8ΓΝ10-5mol/LΘ§‘ρ¥Υ ±»ή“Κ÷–c(CrO42-)=____________ΓΘ
ΔΎ“―÷Σ2AgCl+ CrO42-![]() 2Cl-+Ag2CrO4Θ§ΦΤΥψ≥ωΗΟΖ¥”ΠΒΡΤΫΚβ≥Θ ΐΈΣ____________ΓΘ
2Cl-+Ag2CrO4Θ§ΦΤΥψ≥ωΗΟΖ¥”ΠΒΡΤΫΚβ≥Θ ΐΈΣ____________ΓΘ
Θ®6Θ©œ¬Ν–«ιΩωΜα‘λ≥… Β―ι≤βΕ®ΫαΙϊΤΪΒΆΒΡ «____________ΓΘΘ®Χν±ξΚ≈Θ©
A.ΉΕ–ΈΤΩœ¥Β”ΚσΈ¥Η…‘ο
B.ΒΈΕ®«ΑΘ§Έ¥ Ι”Ο±ξΉΦ“Κ»σœ¥ΒΈΕ®Ιή
C.Υα ΫΒΈΕ®ΙήΒΈΕ®«Α―ω ”ΕΝ ΐΘ§ΒΈΕ®ΚσΗ© ”ΕΝ ΐ
D.Υα ΫΒΈΕ®ΙήΒΈΕ®«ΑΦβΉλ≤ΩΖ÷≥δ¬ζ»ή“ΚΘ§ΒΈΕ®Ϋα χ ±ΒΈΕ®ΙήΦβΉλ”–Τχ≈ί
ΓΨ¥πΑΗΓΩ Υα Ϋ AgNO3»ή“ΚΥ°Ϋβ≥ Υα–‘ CrO 42-+2H+![]() Cr2O72-+H2O ΒΈΦ”ΉνΚσ“ΜΒΈAgNO3»ή“Κ ±Θ§ΑΉ…Ϊ≥ΝΒμΘ®ΜκΉ«Θ©«ΓΚΟ±δ≥…Ή©Κλ…ΪΘ§«“ΑκΖ÷÷”≤Μ±δΜΊ‘≠…Ϊ 14.20 1.8ΓΝ10-2mol/L 1.8ΓΝ10-8 CD
Cr2O72-+H2O ΒΈΦ”ΉνΚσ“ΜΒΈAgNO3»ή“Κ ±Θ§ΑΉ…Ϊ≥ΝΒμΘ®ΜκΉ«Θ©«ΓΚΟ±δ≥…Ή©Κλ…ΪΘ§«“ΑκΖ÷÷”≤Μ±δΜΊ‘≠…Ϊ 14.20 1.8ΓΝ10-2mol/L 1.8ΓΝ10-8 CD
ΓΨΫβΈωΓΩΘ®1Θ©AgNO3ΈΣ«ΩΥα»θΦν―ΈΘ§Υ°Ϋβ Ι»ή“Κ≥ Υα–‘Θ§±Ί–κ ΔΖ≈”ΎΥα ΫΒΈΕ®Ιή÷–ΓΘΙ ¥πΑΗΈΣΘΚΥα ΫΓΔœθΥα“χ»ή“ΚΥ°Ϋβ≥ Υα–‘ΓΘ
Θ®2Θ©K2CrO4”κH+ΜαΖΔ…ζΩ…ΡφΖ¥”ΠΘΚCrO 42-+2H+![]() Cr2O72-+H2OΘ§Υυ“‘Υ°―υ”ΠΒς÷Ν÷––‘Μρ»θΦν–‘ΓΘ
Cr2O72-+H2OΘ§Υυ“‘Υ°―υ”ΠΒς÷Ν÷––‘Μρ»θΦν–‘ΓΘ
Θ®3Θ©Β±Cl-«ΓΚΟ≥ΝΒμΆξ»Ϊ ±Θ§‘ΌΒΈΦ”“ΜΒΈœθΥα“χ»ή“ΚΘ§Ag+ ”κCrO 42-…ζ≥…Ag2CrO4≥ΝΒμΘ§ΑΉ…Ϊ≥ΝΒμ±δ≥…Ή©Κλ…Ϊ≥ΝΒμΘ§«“30sΡΎ≤ΜΆ …ΪΓΘΙ ¥πΑΗΈΣΘΚΒΈΦ”ΉνΚσ“ΜΒΈAgNO3»ή“Κ ±Θ§ΑΉ…Ϊ≥ΝΒμΘ®ΜκΉ«Θ©«ΓΚΟ±δ≥…Ή©Κλ…ΪΘ§«“ΑκΖ÷÷”≤Μ±δΜΊ‘≠…ΪΓΘ
Θ®4Θ©ΒΎ1ΉιœθΥα“χ»ή“ΚΧεΜΐΒΡ ΐΨί”κΒΎ2ΉιΚΆΒΎ3Ήιœύ±»Θ§Έσ≤νΫœ¥σΘ§…α»ΞΒΎ1Ήι ΐΨίΘ§”ΟΒΎ2ΉιΚΆΒΎ3Ήι ΐΨίΒΡΤΫΨυ÷ΒΦΤΥψΓΘœϊΚΡΒΡœθΥα“χ»ή“ΚΒΡΧεΜΐΒΡΤΫΨυ÷ΒΈΣΘ®3.99+4.01Θ©ΓΝ10-3L/2=4ΓΝ10-3LΘ§n(Cl-)=n(Ag+)=4ΓΝ10-3LΓΝ0.001 mol/L=4ΓΝ10-6molΘ§m(Cl-)=4ΓΝ10-6ΓΝ35.5ΓΝ103mg=142ΓΝ10-3mgΘ§Υ°―υ÷–¬»άκΉ”ΒΡΚ§ΝΩΈΣ142ΓΝ10-3mgΓ¬Θ®10ΓΝ10-3LΘ©=14.20 mg/LΓΘ
Θ®5Θ©ΔΌAg+≈®Ε»œύΒ»Θ§ΗυΨίc(Cl-)ΓΝc(Ag +)=1.8ΓΝ10-10Θ§c(CrO42-)ΓΝc2(Ag +)= 1.8ΓΝ10-12 Θ§ΫβΒΟc(CrO42-)=1.8ΓΝ10-2mol/LΘΜ ΔΎΕ‘”Ύ2AgCl+ CrO42-![]() 2Cl-+Ag2CrO4Θ§ΤΫΚβ≥Θ ΐK=c2(Cl-)/c(CrO42-)= c2(Cl-)ΓΝc2(Ag +)/c(CrO42-)ΓΝc2(Ag +)=[ Ksp(AgCl)]2/ Ksp(Ag2CrO4)= (1.8ΓΝ10-10)2/Θ®1.8ΓΝ10-12Θ©=1.8ΓΝ10-10ΓΘ
2Cl-+Ag2CrO4Θ§ΤΫΚβ≥Θ ΐK=c2(Cl-)/c(CrO42-)= c2(Cl-)ΓΝc2(Ag +)/c(CrO42-)ΓΝc2(Ag +)=[ Ksp(AgCl)]2/ Ksp(Ag2CrO4)= (1.8ΓΝ10-10)2/Θ®1.8ΓΝ10-12Θ©=1.8ΓΝ10-10ΓΘ
Θ®6Θ©.ΉΕ–ΈΤΩœ¥Β”Κσ≤Μ–η“ΣΗ…‘οΘ§Ε‘≤βΕ®ΫαΙϊΈό”ΑœλΘΜΒΈΕ®«ΑΘ§Έ¥ Ι”Ο±ξΉΦ“Κ»σœ¥ΒΈΕ®ΙήΘ§±ξΉΦ“Κ≈®Ε»±δ–ΓΘ§ΥυœϊΚΡ±ξΉΦ“ΚΧεΜΐΤΪ¥σΘ§ΫαΙϊΤΪ¥σΘΜΥα ΫΒΈΕ®ΙήΒΈΕ®«Α―ω ”ΕΝ ΐΘ§ΒΈΕ®ΚσΗ© ”ΕΝ ΐΘ§ΒΦ÷¬ΕΝ ΐΤΪ–ΓΘ§ΫαΙϊΤΪΒΆΘΜΥα ΫΒΈΕ®ΙήΒΈΕ®«ΑΦβΉλ≤ΩΖ÷≥δ¬ζ»ή“ΚΘ§ΒΈΕ®Ϋα χ ±ΒΈΕ®ΙήΦβΉλ”–Τχ≈ίΘ§”–≤ΩΖ÷“ΚΧεΈ¥Ζ≈≥ωΘ§ΥυΚΡ±ξΉΦ“ΚΧεΜΐΤΪ–ΓΘ§ΫαΙϊΤΪΒΆΓΘΥυ“‘‘λ≥… Β―ι≤βΕ®ΫαΙϊΤΪΒΆΒΡ «CDΓΘ


 »ΐΒψ“Μ≤βΩλά÷÷ήΦΤΜ°œΒΝ–¥πΑΗ
»ΐΒψ“Μ≤βΩλά÷÷ήΦΤΜ°œΒΝ–¥πΑΗ
| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ≥ΘΈ¬œ¬,Εΰ‘Σ»θΥαH2A»ή“Κ÷–ΒΈΦ”NaOH»ή“Κ,ΥυΒΟΜλΚœ»ή“ΚpH”κάκΉ”≈®Ε»±δΜ·»γΆΦΥυ Ψ,œ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «Θ® Θ©

A. ÷±œΏM±μ ΨpH”κlg![]() ΒΡ±δΜ·ΙΊœΒ
ΒΡ±δΜ·ΙΊœΒ
B. Ka2(H2A)=10-4.3
C. ΫΜΒψeΒΡ»ή“Κ÷–ΘΚc(H2A)=c(A2-)>c(HA-)>c(H+)>c(OH-)
D. fΒψ»ή“Κ÷–ΘΚc(H+)-c(OH-)=c(HA-)+c(A2-)-c(Na+)
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ Β―ι “”ϊ”ΟNaOHΙΧΧε≈δ÷Τ1.0 molΓΛLΘ≠1ΒΡNaOH»ή“Κ240 mLΘΚ
(1)≈δ÷Τ»ή“Κ ±Θ§“ΜΑψΩ…“‘Ζ÷ΈΣ“‘œ¬ΦΗΗω≤Ϋ÷ηΘΚ
ΔΌ≥ΤΝΩΓΓΔΎΦΤΥψΓΓΔέ»ήΫβΓΓΔή“Γ‘»ΓΓΔίΉΣ“ΤΓΓΔόœ¥Β”ΓΓΔΏΕ®»ίΓΓΔύά以ΓΓΔα“ΓΕ·
Τδ’ΐ»ΖΒΡ≤ΌΉςΥ≥–ρΈΣ__________________ΓΘ±Ί–κ”ΟΒΫΒΡ≤ΘΝß“«Τς”–…’±≠ΓΔΫΚΆΖΒΈΙήΓΔ________________ΓΘ
(2)Ρ≥Ά§―ß”ϊ≥ΤΝΩNaOHΒΡ÷ ΝΩΘ§Υϊœ»”ΟΆ–≈ΧΧλΤΫ≥ΤΝΩ…’±≠ΒΡ÷ ΝΩΘ§ΧλΤΫΤΫΚβΚσΒΡΉ¥Χ§»γΆΦΥυ ΨΓΘ…’±≠ΒΡ ΒΦ ÷ ΝΩΈΣ________ gΘ§“ΣΆξ≥…±Ψ Β―ιΗΟΆ§―ß”Π≥Τ≥ω________ g NaOHΓΘ
(3) Ι”Ο»ίΝΩΤΩ«Α±Ί–κΫχ––ΒΡ“Μ≤Ϋ≤ΌΉς «________ΓΘ
(4)»γΆΦ «ΗΟΆ§―ßΉΣ“Τ»ή“ΚΒΡ Ψ“βΆΦΘ§ΆΦ÷–”–ΝΫ¥Π¥μΈσΘ§«κ–¥≥ωΘΚ
ΔΌ________________________________________________________________________
ΔΎ________________________________________________________________________
(5)‘Ύ≈δ÷ΤΙΐ≥Χ÷–Θ§ΤδΥϊ≤ΌΉςΕΦ «’ΐ»ΖΒΡΘ§œ¬Ν–≤ΌΉςΜα“ΐΤπΈσ≤νΤΪΗΏΒΡ «________(ΧνΉ÷ΡΗ)ΓΘ
AΘ°Υυ”ΟNaOH“―Ψ≠≥±Ϋβ
BΘ°œρ»ίΝΩΤΩ÷–Φ”Υ°Έ¥ΒΫΩΧΕ»œΏ
CΘ°”–…ΌΝΩNaOH»ή“Κ≤–Ντ‘Ύ…’±≠άο
DΘ°”Ο¥χ”Έ¬κΒΡΆ–≈ΧΧλΤΫ≥Τ5.4 g NaOH(1 g“‘œ¬”Ο”Έ¬κ) ±Έσ”ΟΝΥΓΑΉσ¬κ”“ΈοΓ±ΖΫΖ®
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ≤ώΨ≤Έμω≤Βς≤ιΦΆ¬ΦΤ§ΓΕώΖΕΞ÷°œ¬ΓΖ÷–ΒΡPM2.5 «Ω’ΤχΈέ»ΨΈο÷°“ΜΘ§Τδ÷–PM2.5 ÷Η( )
A. ΙΧΧε–ΓΩ≈ΝΘ B. SO2 C. ΒΣ―θΜ·Έο D. CO2
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
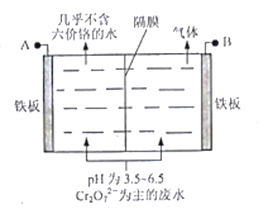
ΓΨΧβΡΩΓΩK2Cr2O7 «“Μ÷÷÷Ί“ΣΒΡΜ·ΙΛ‘≠ΝœΓΘ“‘ΗθΧζΩσ(÷ς“Σ≥…Ζ÷ΈΣFeOΓΛCr2O3Θ§ΜΙΚ§”–Al2O3ΓΔFe2O3Β»‘”÷ )ΈΣ‘≠Νœ÷Τ±ΗK2Cr2O7ΒΡ“Μ÷÷ΙΛ“’Νς≥Χ»γœ¬ΘΚ

“―÷ΣΘΚ
ΔΌ4FeOΓΛCr2O3+8Na2CO3+7O2 ![]() 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
ΔΎCr2O72-+H2O![]() 2CrO42-+2H+
2CrO42-+2H+
Θ®1Θ©ΓΑ±Κ…’Γ± ±Θ§Al2O3”κNa2CO3ΖΔ…ζΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣ___________ΓΘ
Θ®2Θ©ΓΑ¬Υ‘ϋΓ±ΒΡ÷ς“Σ≥…Ζ÷ «________(ΧνΜ·―ß Ϋ).
Θ®3Θ©ΓΑΥαΜ·Γ±≤Ϋ÷ηΒςΫΎ»ή“ΚpH<5Θ§ΤδΡΩΒΡ «_________
Θ®4Θ©ΓΑΉΣΜ·Γ±“Μ≤ΫΖΔ…ζΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣ____________
Θ®5Θ©≤…”ΟΒγΫβΖ®¥ΠάμΚ§ΗθΖœΥ°‘≠άμ»γœ¬ΆΦΥυ ΨΓΘ―τΦΪ«χ»ή“Κ÷–ΖΔ…ζΖ¥”ΠΘΚCr2O72-+6Fe2++14H+ == 2Cr3+ +6Fe3+ + 7H2OΘ§―τΦΪΒΡΒγΦΪΖ¥”Π ΫΈΣ_______Θ§“θΦΪ≤ζ…ζΒΡΤχΧεΈΣ_______(ΧνΜ·―ß Ϋ)ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΧζ‘ΣΥΊ‘ΎΒγΜ·―ß÷–”Π”ΟΙψΖΚΓΘΜΊ¥πœ¬Ν–Έ ΧβΘΚ
Θ®1Θ©ΗυΨίΖ¥”Π2Fe3++Cu==2Fe2++Cu2+…ηΦΤ‘≠Βγ≥Ί»γΆΦΓΘΒγΝςΦΤœ‘ ΨΒγΝςΖΫœρΈΣΘΚaΓζbΓΘ

ΔΌΒγΦΪBΈΣ____________Θ§ΒγΫβ÷ »ή“ΚCΈΣ_____________ΓΘΘ®Χν±ξΚ≈Θ©
A,ΧΦΑτ B.Ά≠Τ§ C.Fe2(SO4)3»ή“Κ D.CUSO4»ή“Κ
ΔΎAΒγΦΪΒΡΒγΦΪΖ¥”Π ΫΈΣ________________________________________ΓΘ
Δέ”ΟΗΟΒγ≥ΊΉωΒγ‘¥Θ§ΒγΫβΝρΥαΡΤ»ή“ΚΘ§Β±ΒγΫβ≥Ί―τΦΪ”–11.2mLΤχΧεΘ®±ξΉΦΉ¥ΩωΘ©≤ζ…ζ ±Θ§ΗΟΒγ≥Ί”–__________________molFe3+±ΜΜΙ‘≠ΓΘ
Θ®2Θ©NaFeO4 «“Μ÷÷”ΟΆΨΙψΖΚΒΡΜ·ΙΛ≤ζΤΖΘ§ΙΛ“Β…œ≥Θ”ΟΒγΫβΖ®÷Τ»ΓΓΘ÷Τ»ΓΉΑ÷Ο»γΆΦΓΘ“―÷ΣNa2FeO4÷Μ‘Ύ«ΩΦν–‘ΧθΦΰœ¬±»ΫœΈ»Ε®Θ§ΨΏ”–«Ω―θΜ·–‘ΓΘ

ΔΌNa2FeO4÷–Χζ‘ΣΥΊΜ·ΚœΦέΈΣ_____________ Na2FeO4 «ΨΏ”–…±Ψζ–ßΙϊΒΡΨΜΥ°ΦΝΓΘ‘≠“ρ «_________________________________________________ΓΘ
ΔΎΒγΦΪNiΈΣ_________________Θ®ΧνΓΑ―τΓ±ΜρΓΑ“θΓ±Θ©ΦΪΓΘΈΣ ΙΗΟΉΑ÷ΟΡή≥÷–χΖ¥”ΠΘ§άκΉ”ΫΜΜΜΡΛ”ΠΈΣ__________________________Θ®ΧνΓΑ―τΓ±ΜρΓΑ“θΓ±Θ©άκΉ”ΫΜΜΜΡΛΓΘ
Δέ―τΦΪΖ¥”Π ΫΈΣ_______________________________________ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ¬Ν–ΗςΉιΈο÷ ÷–»Ϊ τ”Ύ”–ΜζΈοΒΡ «__________ΘΜ»Ϊ τ”ΎΧΰΒΡ «__________ΓΘ
A.CH4ΓΔC2H5OHΓΔC6H12O6(ΙϊΧ«)ΓΔ(C6H10O5)n(ΒμΖέ)
B.C2H2ΓΔH2O2ΓΔCCl4ΓΔC6H6
C.CH4ΓΔC2H4ΓΔH2CO3ΓΔCH3Cl
D.CH4ΓΔC2H6ΓΔC2H2ΓΔC6H6
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
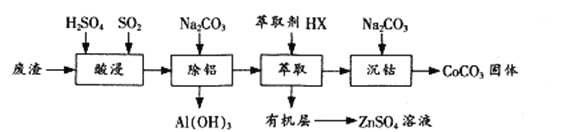
ΓΨΧβΡΩΓΩΙΐΕ…Ϋπ τ¥ΏΜ·ΒΡΖ¥”Π“―≥…ΈΣ÷Ί“ΣΒΡΚœ≥…ΙΛΨΏΘ§ΙσΫπ τ≥…±ΨΗΏΘ§ΜαΕ‘ΜΖΨ≥‘λ≥…ΒΡ≤Μάϊ”ΑœλΓΘ“ρ¥Υ―–ΨΩ≥…±ΨΒΆΝ°ΒΡΚ§ΟΧΓΔΧζΓΔνήΓΔΡχΓΔΆ≠Β»¥ΏΜ·ΦΝ”Π”Ο≥…ΈΣ»»ΒψΓΘ“‘œ¬ «“‘Κ§νήΖœ‘ϋΘ®÷ς“Σ≥…Ζ÷CoOΓΔCo2O3Θ§ΜΙΚ§”–Al2O3ΓΔZnOΒ»‘”÷ Θ©ΈΣ‘≠Νœ÷Τ±ΗCoCO3ΒΡ“Μ÷÷ΙΛ“’Νς≥ΧΘΚ
œ¬±μΝ–≥ωΝΥœύΙΊΫπ τάκΉ”…ζ≥…«β―θΜ·Έο≥ΝΒμΒΡpHΘ®ΩΣ Φ≥ΝΒμΒΡpHΑ¥Ϋπ τάκΉ”≈®Ε»ΈΣ1.0 mol/LΦΤΥψΘ©
Ϋπ τάκΉ” | ΩΣ Φ≥ΝΒμΒΡpH | ≥ΝΒμΆξ»ΪΒΡpH |
Co2+ | 7.6 | 9.4 |
Al3+ | 3.0 | 5.0 |
Zn2+ | 5.4 | 8.0 |
ΜΊ¥πœ¬Ν–Έ ΧβΘΚ
Θ®1Θ©ΓΑΥαΫΰΓ± ±Ά®»κSO2ΒΡΡΩΒΡ « ____________Θ§Ζ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΈΣ______________ΓΘ
Θ®2Θ©ΓΑίΆ»ΓΓ±Ιΐ≥ΧΩ…±μ ΨΈΣZnSO4Θ®Υ°≤ψΘ©+2HXΘ®”–Μζ≤ψΘ©![]() ZnX2Θ®”–Μζ≤ψΘ©+H2SO4Θ®Υ°≤ψΘ©Θ§”…”–Μζ≤ψΜώ»ΓZnSO4»ή“ΚΒΡ≤ΌΉς « __________________ΓΘ
ZnX2Θ®”–Μζ≤ψΘ©+H2SO4Θ®Υ°≤ψΘ©Θ§”…”–Μζ≤ψΜώ»ΓZnSO4»ή“ΚΒΡ≤ΌΉς « __________________ΓΘ
Θ®3Θ©ΓΑ≥ΝνήΓ± ±Na2CO3»ή“Κ–ηΜΚ¬ΐΒΈΦ”ΒΡ‘≠“ρ « ____________ΓΘ
Θ®4Θ©”ΟΒΟΒΫΒΡCoCO3Β»ΈΣ‘≠Νœ≤…”ΟΈΔ≤®Υ°»»Ζ®ΚΆ≥ΘΙφΥ°»»Ζ®Ω…“‘÷ΤΒΟΝΫ÷÷CoxNi(1-x)Fe2O4Θ®Τδ÷–CoΓΔNiΨυΈΣ+2ΦέΘ©Θ§ΨυΩ…”ΟΉςH2O2Ζ÷ΫβΒΡ¥ΏΜ·ΦΝΘ§”–ΫœΗΏΒΡΜν–‘ΓΘ»γΆΦ «ΝΫ÷÷≤ΜΆ§ΖΫΖ®÷ΤΒΟΒΡCoxNi(1-x)Fe2O4‘Ύ10Γφ ±¥ΏΜ·Ζ÷Ϋβ6%ΒΡH2O2»ή“ΚΒΡœύΕ‘≥θ ΦΥΌ¬ Υφx±δΜ·«ζœΏΓΘ”…ΆΦ÷––≈œΔΩ…÷ΣΘΚ____________Ζ®÷Τ»ΓΒΟΒΫΒΡ¥ΏΜ·ΦΝΜν–‘ΗϋΗΏΘ§”…¥ΥΆΤ≤βCo2+ΓΔNi2+ΝΫ÷÷άκΉ”÷–¥ΏΜ·–ßΙϊΗϋΚΟΒΡ «____________ ΓΘ
Θ®5Θ©”Ο¥ΩΦν≥ΝΒμΉΣΜ·Ζ®“≤Ω…“‘¥”≤ίΥανή(CoC2O4)ΖœΝœΒΟΒΫCoCO3Θ§œρΚ§”–CoC2O4ΙΧΧεΒΡ»ή“Κ÷–ΒΈΦ”Na2CO3»ή“ΚΘ§Β±”–CoCO3≥ΝΒμ…ζ≥… ±Θ§»ή“Κ÷–![]() =___________ΓΘ[“―÷ΣKsp(CoC2O4)=6.3ΓΝ10-8 Ksp (CoCO3)=1.4ΓΝ10- 13]
=___________ΓΘ[“―÷ΣKsp(CoC2O4)=6.3ΓΝ10-8 Ksp (CoCO3)=1.4ΓΝ10- 13]
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ25Γφ ±Θ§œρ25mL 0.1000mo1ΓΛL-1 HA»ή“ΚΒΈΦ”Ά§≈®Ε»ΒΡBOH»ή“ΚΘ§ΜλΚœ»ή“ΚpHΥφΒΈΦ”BOH»ή“ΚΒΡ±δΜ·»γœ¬ΆΦΥυ ΨΓΘœ¬Ν–”–ΙΊ–π ω¥μΈσΒΡ «
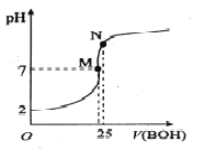
A. BA»ή“Κ≥ Φν–‘
B. ΥαHAΒΡΒγάκ≥Θ ΐ‘ΦΈΣ0.0011
C. MΒψ ±c(B+Θ©=c(A-Θ©> c(H+Θ©= c(OH-Θ©
D. NΒψ ±Φ”»κ10mL0.1mol/L HA»ή“ΚΘ§ΫΪ¥ΌΫχA-ΒΡΥ°Ϋβ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΙζΦ ―ß–Θ”≈―Γ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com