
����Ŀ��ʵ��������NaOH��������1.0 mol��L��1��NaOH��Һ240 mL��
(1)������Һʱ��һ����Է�Ϊ���¼������裺
�ٳ������ڼ��㡡���ܽ⡡��ҡ�ȡ���ת�ơ���ϴ�ӡ��߶��ݡ�����ȴ����ҡ��
����ȷ�IJ���˳��Ϊ__________________�������õ��IJ����������ձ�����ͷ�ιܡ�________________��
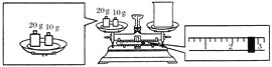
(2)ijͬѧ������NaOH��������������������ƽ�����ձ�����������ƽƽ����״̬��ͼ��ʾ���ձ���ʵ������Ϊ________ g��Ҫ��ɱ�ʵ���ͬѧӦ�Ƴ�________ g NaOH��
(3)ʹ������ƿǰ������е�һ��������________��
(4)��ͼ�Ǹ�ͬѧת����Һ��ʾ��ͼ��ͼ��������������д����
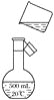
��________________________________________________________________________
��________________________________________________________________________
(5)�����ƹ����У���������������ȷ�ģ����в������������ƫ�ߵ���________(����ĸ)��
A������NaOH�Ѿ�����
B��������ƿ�м�ˮδ���̶���
C��������NaOH��Һ�������ձ���
D���ô������������ƽ��5.4 g NaOH(1 g����������)ʱ����������������������
���𰸡��ڢ٢ۢ�ݢޢ�ߢ� 250 mL����ƿ ������ 27.4 10.0 ��© Ӧ��Ϊ250mL������ƿ����ҺʱӦ�ò����������� B
��������
��1������һ�����ʵ���Ũ����Һһ�㲽�裺���㡢�������ܽ⡢��ȴ����Һ��ϴ�ӡ����ݡ�ҡ�ȡ�װƿ������ǩ��������ȷ��˳��Ϊ���ڢ٢ۢ�ݢޢߢܣ��õ�����������Ϊ��������ƽ��ҩ�ס����������ձ�������ƿ�ͽ�ͷ�ιܣ�Ҫ����1.0mol/L��NaOH��Һ240mL��Ӧѡ��250mL����ƿ�����Ի�ȱ�ٵ�������250mL����ƿ�����������ʴ�Ϊ���ڢ٢ۢ�ݢޢ�ߢ���250mL����ƿ����������
��2��������ƽ��������ԭ����֪����������=���������+���������������������Ϊ20g��10g����������2.6g�������ձ���ʵ������Ϊ27.4g������1.0molL-1��NaOH��Һ240mL��Ӧѡ��250mL����ƿ������250mL��Һ����Ҫ������������m=1.0mol/L��40g/mol��0.25L=10.0g���ʴ�Ϊ��27.4��10.0��
��3������ƿ���л�����ʹ�ù�������Ҫ���µߵ�������ʹ��ǰӦ����Ƿ�©ˮ���ʴ�Ϊ����©��
��4������ͬѧѡ�õ�����ƿ����Ӧ��Ϊ250mL������ƿ������ҺʱӦ�ò�������������Ϊ��Ӧ��Ϊ250mL������ƿ����ҺʱӦ�ò�����������
��5��A.NaOH�ѳ��⣬�������ʵ����ʵ���ƫС����ҺŨ��ƫ�ͣ���A������
B.����Һ�м�ˮδ���̶��ߣ�������Һ���ƫС����ҺŨ��ƫ�ߣ���B��ȷ��
C.�ܽ��NaOH�����������ձ��У��������ʵ����ʵ���ƫС����ҺŨ��ƫ�ͣ���C����
D.����NaOH���ŷ�ʱ��������ʵ������Ϊ4.6g���������ʵ����ʵ���ƫС����ҺŨ��ƫ�ͣ���D����ΪB��
��1������һ�����ʵ���Ũ����Һһ�㲽�裺���㡢�������ܽ⡢��ȴ����Һ��ϴ�ӡ����ݡ�ҡ�ȡ�װƿ������ǩ��������ȷ��˳��Ϊ���ڢ٢ۢ�ݢޢߢܣ��õ�����������Ϊ��������ƽ��ҩ�ס����������ձ�������ƿ�ͽ�ͷ�ιܣ�Ҫ����1.0mol/L��NaOH��Һ240mL��Ӧѡ��250mL����ƿ�����Ի�ȱ�ٵ�������250mL����ƿ�����������ʴ�Ϊ���ڢ٢ۢ�ݢޢ�ߢ���250mL����ƿ����������
��2��������ƽ��������ԭ����֪����������=���������+���������������������Ϊ20g��10g����������2.6g�������ձ���ʵ������Ϊ27.4g������1.0molL-1��NaOH��Һ240mL��Ӧѡ��250mL����ƿ������250mL��Һ����Ҫ������������m=1.0mol/L��40g/mol��0.25L=10.0g���ʴ�Ϊ��27.4��10.0��
��3������ƿ���л�����ʹ�ù�������Ҫ���µߵ�������ʹ��ǰӦ����Ƿ�©ˮ���ʴ�Ϊ����©��
��4���ٸ�ͬѧѡ�õ�����ƿ����Ӧ��Ϊ250mL������ƿ������ҺʱӦ�ò�������������Ϊ��Ӧ��Ϊ250mL������ƿ����ҺʱӦ�ò�����������
��5��A.NaOH�ѳ��⣬�������ʵ����ʵ���ƫС����ҺŨ��ƫ�ͣ���A����
B.����Һ�м�ˮδ���̶��ߣ�������Һ���ƫС����ҺŨ��ƫ�ߣ���B��ȷ��
C.�ܽ��NaOH�����������ձ��У��������ʵ����ʵ���ƫС����ҺŨ��ƫ�ͣ���C����
D.����NaOH���ŷ�ʱ��������ʵ������Ϊ4.6g���������ʵ����ʵ���ƫС����ҺŨ��ƫ�ͣ���D����ΪB��


 �������¿��ÿ�ʱ��ҵϵ�д�
�������¿��ÿ�ʱ��ҵϵ�д� Ӣ�żƻ�ͬ����ʱ��Чѵ��ϵ�д�
Ӣ�żƻ�ͬ����ʱ��Чѵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ӱ�컯ѧ��Ӧ���ʵ���������У��϶���ʹ��ѧ��Ӧ���ʼӿ�ķ����ǣ� ��
�������¶ȣ�������ѹǿ��������Ӧ������ʵ������ܽ���״���巴Ӧ��ĥ�ɷ�ĩ
A.�٢ڢۢ�B.�٢�C.�٢ۢ�D.�٢ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1mol��ϩ��������ȫ�ӳɺ���������ȡ���������������������Ϊ
A��5mol B��6mol C��7mol D��8mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڳ�����pH=3��HF��Һ������������ȷ����
A. c(H+)=c(F-)
B. ��ˮϡ��ʱ��c(F-)/c(HF)����
C. ��pH=11��NaOH��Һ�������Ϻ���Һ�ʼ���
D. ����NaF�����������HF�ĵ��룬ʹ��Һ��c(F-)��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ÿ����붬�����ҹ�������оͻ�����������������������ܼ��������γɵ���( )
A. �н�¶����սո� B. �ƹ�ʹ��ȼú����
C. ����ʹ�û������� D. ������̫���ܷ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����
A. 95��ʱ��ˮ��pH<7��˵�����ȿɵ���ˮ������
B. pH=3�Ĵ�����Һ��ϡ����10��ʱ��Һ��pH<4
C. ��Ũ�ȵĴ�����Һ������������Һ�������Ϻ�pH=7
D. �����pH��Ϊ3�Ĵ��������ֱ�������Zn��Ӧ�����������H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����ӷ���ʽ�������
A. H2Sͨ��CuSO4��Һ�У�H2S+Cu2+==CuS��+2H+
B. AlCl3��Һ��Na2S��Һ������ɳ���:��2 Al3++3S2-==Al2S3��
C. �ö��Ե缫���BaCl2��Һ��2Cl-+2H2O![]() Cl2��+H2��+2OH-
Cl2��+H2��+2OH-
D. ��TiCl4�Ʊ�TiO2�ĵ�һ����Ӧ��Ti4++ (x+2) H2O(����)![]() TiO2��xH2O��+ 4H+
TiO2��xH2O��+ 4H+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ˮ�������ӵIJⶨ�����彡������Ҫ���壬ʵ���ҳ���Ī�����ⶨˮ���������Ӻ�����ʵ��������£���ˮ���м���K2CrO4 (��ɫ) ��Һ��ָʾ������AgNO3��Һ�ζ����յ㡣��֪��Ag2CrO4Ϊ������ˮ��ש��ɫ������������Ksp(AgCl)=1.8��10-10��Ksp(Ag2CrO4)= 1.8��10-12��
�ش��������⣺
��1���ζ�ʱ��Ӧʹ��____________(���ʽ����ʽ��) �ζ��ܣ�ԭ����_______________________��
��2��ˮ��Ӧ�������Ի������ԣ�ǿ����ʱ����K2CrO4��Һ������Ӧ�����ӷ���ʽ��___________________________________________��
��3���ζ��ﵽ�յ�ı�־��___________________________________________��
��4��ʵ������в���������±���
��� | 1 | 2 | 3 |
V(ˮ��)/mL | 10.00 | 10.00 | 10.00 |
c(AgNO3)/ mol��L-1 | 0.0010 | ||
V(AgNO3)/mL | 3.75 | 4.01 | 3.99 |
����ˮ���������ӵĺ���Ϊ_______________mg/L������2λС����
��5���������
�ٵ���Һ�еIJ���c(Cl-)=1.8��10-5mol/L�����ʱ��Һ��c(CrO42-)=____________��
����֪2AgCl+ CrO42-![]() 2Cl-+Ag2CrO4��������÷�Ӧ��ƽ�ⳣ��Ϊ____________��
2Cl-+Ag2CrO4��������÷�Ӧ��ƽ�ⳣ��Ϊ____________��
��6��������������ʵ��ⶨ���ƫ�͵���____________�������ţ�
A.��ƿϴ�Ӻ�δ����
B.�ζ�ǰ��δʹ�ñ�Һ��ϴ�ζ���
C.��ʽ�ζ��ܵζ�ǰ���Ӷ������ζ����Ӷ���
D.��ʽ�ζ��ܵζ�ǰ���첿�ֳ�����Һ���ζ�����ʱ�ζ��ܼ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.12mol FeCl2����100ml K2Cr2O7��Һ�У�ǡ��ʹ��Һ��Fe2+ȫ��ת��ΪFe3+��Cr2O72������ԭΪCr3+����K2Cr2O7��Һ�����ʵ���Ũ��Ϊ
A. 0.4mol/L B. 0.1mol/L C. 0.2mol/L D. 0.08mol/L
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com