
【题目】下列叙述正确的是
A. 95℃时纯水的pH<7,说明加热可导致水呈酸性
B. pH=3的醋酸溶液,稀释至10倍时溶液的pH<4
C. 等浓度的醋酸溶液与氢氧化钠溶液等体积混合后pH=7
D. 等体积pH均为3的醋酸和盐酸分别与足量Zn反应,盐酸产生的H2多
【答案】B
【解析】A、水的电离是吸热反应,升温水的电离平衡正向移动,H+和OH-浓度同时增大,均大于10-7mol/L,所以pH<7,但H+和OH-浓度仍相等,水还是显中性,A错误;B、CH3COOH![]() CH3COO-+H+,稀释10倍,若平衡不移动,H+浓度将变为10-4mol/L,但稀释促使醋酸的电离平衡正向移动,H+浓度大于10-4mol/L,所以pH<4,B正确;C、等浓度的醋酸溶液与氢氧化钠溶液等体积混合后,两者恰好完全反应生成醋酸钠,溶液呈碱性,C错误;D、醋酸是弱酸,部分电离,所以pH均为3的醋酸和盐酸中,醋酸的物质的量浓度比盐酸的物质的量浓度大,体积相等时,醋酸能电离出的所有H+的物质的量大,生成的H2更多,D错误。正确答案为B。
CH3COO-+H+,稀释10倍,若平衡不移动,H+浓度将变为10-4mol/L,但稀释促使醋酸的电离平衡正向移动,H+浓度大于10-4mol/L,所以pH<4,B正确;C、等浓度的醋酸溶液与氢氧化钠溶液等体积混合后,两者恰好完全反应生成醋酸钠,溶液呈碱性,C错误;D、醋酸是弱酸,部分电离,所以pH均为3的醋酸和盐酸中,醋酸的物质的量浓度比盐酸的物质的量浓度大,体积相等时,醋酸能电离出的所有H+的物质的量大,生成的H2更多,D错误。正确答案为B。


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:
【题目】水的离子积常数Kw与温度T(℃)有关:
(1)若T=25℃时,Kw=____________,若T=100℃时,Kw=1×10-12,则此温度下0.05mol/LBa(OH)2 溶液的pH=____________.
(2)已知25℃时,0.1L 0.1molL-1的NaA溶液的pH=10,用离子方程式表示其原因为______________;
(3)25℃时,将pH=11的NaOH溶液与pH=4的硫酸溶液混合,若所得混合溶液pH=9,则NaOH溶液与硫酸溶液的体积比为_____________(混合后的体积变化忽略不计).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海藻中含有丰富的碘元素。如图是实验室从海藻里提取碘的流程的一部分。下列判断正确的是

A. 步骤④的操作是过滤
B. 可用淀粉溶液检验步骤②的反应是否进行完全
C. 步骤①、③的操作分别是过滤、萃取
D. 步骤③中加入的有机溶剂可能是酒精或四氯化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲用NaOH固体配制1.0 mol·L-1的NaOH溶液240 mL:
(1)配制溶液时,一般可以分为以下几个步骤:
①称量 ②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却 ⑨摇动
其正确的操作顺序为__________________。必须用到的玻璃仪器有烧杯、胶头滴管、________________。
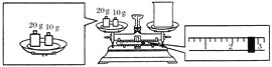
(2)某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图所示。烧杯的实际质量为________ g,要完成本实验该同学应称出________ g NaOH。
(3)使用容量瓶前必须进行的一步操作是________。
(4)如图是该同学转移溶液的示意图,图中有两处错误,请写出:
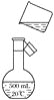
①________________________________________________________________________
②________________________________________________________________________
(5)在配制过程中,其他操作都是正确的,下列操作会引起误差偏高的是________(填字母)。
A.所用NaOH已经潮解
B.向容量瓶中加水未到刻度线
C.有少量NaOH溶液残留在烧杯里
D.用带游码的托盘天平称5.4 g NaOH(1 g以下用游码)时误用了“左码右物”方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对反应Al2O3+N2+3C ![]() 2AlN+3CO的叙述正确的是
2AlN+3CO的叙述正确的是
A. Al2O3是氧化剂,C是还原剂 B. 每生成1 mol CO需转移2 mol电子
C. AlN中氮元素的化合价为+3 D. N2发生了氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】柴静雾霾调查纪录片《穹顶之下》中的PM2.5是空气污染物之一,其中PM2.5 指( )
A. 固体小颗粒 B. SO2 C. 氮氧化物 D. CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁元素在电化学中应用广泛。回答下列问题:
(1)根据反应2Fe3++Cu==2Fe2++Cu2+设计原电池如图。电流计显示电流方向为:a→b。

①电极B为____________,电解质溶液C为_____________。(填标号)
A,碳棒 B.铜片 C.Fe2(SO4)3溶液 D.CUSO4溶液
②A电极的电极反应式为________________________________________。
③用该电池做电源,电解硫酸钠溶液,当电解池阳极有11.2mL气体(标准状况)产生时,该电池有__________________molFe3+被还原。
(2)NaFeO4是一种用途广泛的化工产品,工业上常用电解法制取。制取装置如图。已知Na2FeO4只在强碱性条件下比较稳定,具有强氧化性。

①Na2FeO4中铁元素化合价为_____________ Na2FeO4是具有杀菌效果的净水剂。原因是_________________________________________________。
②电极Ni为_________________(填“阳”或“阴”)极。为使该装置能持续反应,离子交换膜应为__________________________(填“阳”或“阴”)离子交换膜。
③阳极反应式为_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知高能锂离子电池的总反应式为2Li+FeS=Fe+Li2S,LiPF6·SO(CH3)2为电解质,用该电池为电源电解含镍酸性废水并得到单质Ni的实验装置如图所示。下列说法不正确的是

A. 电极Y为Li
B. 电解过程中,b中NaCl溶液的物质的量浓度将不断减小
C. X极反应式为FeS+2Li++2e-=Fe+Li2S
D. 若将图中阳离子膜去掉,将a、b两室合并,则电解反应总方程式发生改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com