
CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。已知:
①CuCl可以由CuCl2用适当的还原剂如SO2、SnCl2等还原制得:
②CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子:
请回答下列问题:
(1)基态Cu原子的核外电子排布式为 ,H、N、O三种元素的电负性由大到小的顺序是 。
(2)SO2分子的空间构型为 ,与SnCl4互为等电子体的一种离子的化学式为 。
(3)乙二胺分子中氮原子轨道的杂化类型为 ,乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是 。
(4)②中所形成的配离子中含有的化学键类型有 。(填字母)
A 配位键 B 极性键 C 离子键 D 非极性键
(5)CuCl的晶胞结构如上图所示,其中Cl原子的配位数为 。
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:
| ||


查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,超细铜粉可应用于导电材料、催化剂等领域中,CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.
铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,超细铜粉可应用于导电材料、催化剂等领域中,CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.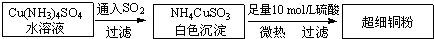
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,超细铜粉可应用于导电材料、催化剂等领域中,CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。
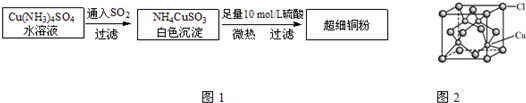
⑴超细铜粉的某制备方法如下:
①[Cu(NH3)4]SO4中所含的化学键有 、 、 ,
N、O、S三种元素的第一电离能大小顺序为: > > 。(填元素符号)
②NH4CuSO3中的金属阳离子的核外电子排布式为: 。
③ NH3分子中N原子的杂化方式为: 。
④与SO2互为等电子体的分子有 (写一种)。
⑵氯化亚铜(CuCl)的某制备过程是:向CuCl2溶液中通人一定量SO2,微热,反应一段时间后即生成CuCl白色沉淀。
①CuCl的晶胞结构如下图所示,其中Cl原子的配位数为_________。
②CuCl的熔点比CuO的熔点 。(填“高”或“低”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com