
【题目】氮氧化物是环境污染物,研究氮氧化物转化有重要的意义。
回答下列问题
(1)催化转化器可使汽车尾气反应而转化:
2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H
N2(g)+2CO2(g) △H
已知:N2(g)+O2(g)==2NO(g) △H1= a kJ·mol-1
2C(s)+O2(g)==2CO(g) △H2= b kJ·mol-1
C(s)+ O2(g)=CO2(g) △H3= c kJ·mol-1
△H=___________ kJ·mol-1(用含a、b、c的代数式表示)
(2)T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中发生尾气转化反应,容器中NO物质的量随时间变化如图所示。

①T℃时,该化学反应的平衡常数K=___________。
②下列事实无法判断汽车尾气转化反应达到到化学平衡状态的是___________;
A.NO消耗速率等于N2消耗速率的2倍 B.混合气体平均相对分子质量不再变化
C.体系中NO的转化率和CO的转化率相等 D.气体的密度不再变化
③已知汽车尾气转化反应的△H<0。10min后,改变下列示意图横坐标对应的反应条件,纵坐标对应的量变化关系正确的是___________。(填序号)

(3)碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步I2(g)![]() 2I(g)(快反应)
2I(g)(快反应)
第二步I(g)+N2O(g)→N2(g)+IO(g)(慢反应)
第三步IO(g)+N2O(g)→N2(g)+O2(g)+I2(g)(快反应)
实验表明,含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)0.5(k为速率常数)。下列表述正确的是___________(填标号)。
A.N2O分解反应中,k值与是否含碘蒸气无关
B.第二步对总反应速率起决定作用
C.第二步活化能比第三步小
D.IO为反应的中间产物
(4)碱吸收、碳还原是目前工业生产中处理氮氧化物的常用方法。
①碱吸收的常见产物为NaNO2。常温下,pH=8的NaNO2溶液中c(Na+)-c(NO2-)=___________mol·L-1(用精确值表示)
②碳还原法是在高温条件下将NO与NO2混合气体与焦炭反应,生成CO和N2。已知,采用碳还原法处理某工厂氮氧化物废气时,生成的CO与N2的物质的量之比为4︰3。则该工厂尾气中NO和NO2的物质的量比为___________。
【答案】2c-a-b 2.5 CD bc BD 9.9×10-7或10-6-10-8 2:1
【解析】
(1)利用盖斯定律计算;
(2)①三行式法进行计算;
②当反应过程中的变量不再发生改变,说明反应达到了平衡,可以作为判断是否达到平衡状态的依据;如果在反应过程中,一直是定值不可作为判断是否达到平衡状态的依据;
③a.平衡常数只与温度有关;b.当反应物为两种或两种以上时,增加反应物的浓度,平衡正向移动,但增加的反应物转化率下降,其他反应物转化率上升;c. △H的大小与投入量无关;d.升温平衡吸热方向移动.
(3)A.碘蒸气存在能大幅度提高N2O的分解速率,因此碘蒸气存在影响k,故A不正确;
B.第二步反应慢 所以对总反应速率起决定作用,故B正确;
C.第二步反应比第三步反应慢,说明第二步活化能大,故C不正确;
D.IO为反应的中间产物,故D正确;
(4)①电荷守恒法进行计算;
②利用原子守恒和氧化还原反应得失电子数相等列等式。
(1)利用盖斯定律,
2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H
N2(g)+2CO2(g) △H
已知:N2(g)+O2(g)==2NO(g) △H1= a kJ·mol-1 ①
2C(s)+O2(g)==2CO(g) △H2= b kJ·mol-1 ②
C(s)+ O2(g)=CO2(g) △H3= c kJ·mol-1 ③
2×③- ①-②得2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H=(2c-a-b)kJ·mol-1
N2(g)+2CO2(g) △H=(2c-a-b)kJ·mol-1
正确答案:2c-a-b
(2)①三行式法进行计算;
2NO(g) + 2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
c(初) 0.4 0.4 0 0
△c 0.2 0.2 0.1 0.2
c(平衡)0.2 0.2 0.1 0.2
K=![]() =2.5
=2.5
正确答案:2.5
②当反应过程中的变量不再发生改变,说明反应达到了平衡,可以作为判断是否达到平衡状态的依据;如果在反应过程中,一直是定值不可作为判断是否达到平衡状态的依据;A.NO消耗速率等于N2消耗速率的2倍,说明正反应速率和逆反应速率相等,达到平衡;B.正反应方向是气体分子数减少的反应,故正反应使混合气体的平均相对分子质量增大。当混合气体平均相对分子质量不再变化时,达到平衡;C.体系中NO的转化率和CO的转化率相等,不能说明转化率不再发生变化,故无法判断是否达到平衡状态;D.该反应是在恒温恒容条件下进行的,气体的质量和体积均保持不变,故气体的密度保持不变。当气体的密度不再变化时,无法判断该反应是否达到平衡状态。
综上所述,无法判断汽车尾气转化反应达到到化学平衡状态的是:CD。
③a.平衡常数只与温度有关,故a不正确;
b.当反应物为两种或两种以上时,增加反应物的浓度,平衡正向移动,但增加的反应物转化率下降,其他反应物转化率上升,故b正确;
c. △H的大小与投入量无关,故c正确;
d.该反应为放热反应,升温使该反应的化学平衡向吸热方向移动、CO的转化率减少,不可能一直增大,故d不正确;
正确答案:bc
(3) A. 碘蒸气存在能大幅度提高N2O的分解速率,根据题中信息,K为有碘蒸气存在时的N2O分解速率的速率常数,若没有碘存在,K就没有意义了,因此K的取值与碘蒸气有关,故A不正确;
B.第二步反应慢 所以对总反应速率起决定作用,故B正确;
C.第二步反应比第三步反应慢,说明第二步活化能大,故C不正确;
D.从总反应N2O(g)→N2(g)+O2(g)来看,IO在反应前没有、反应后也没有,故其为反应的中间产物,故D正确;
正确答案:BD。
(4) ① 常温下pH=8的溶液中氢离子浓度为1×10-8molL-1,氢氧根离子浓度为1×10-6molL-1,由电荷守恒可c(Na+)+c(H+)=c(OH-)+c(NO2-)可知:c(Na+)-c(NO2-)=c(OH-)-c(H+)=1×10-6mol/L-1-10-8mol/L≈9.9×10-7molL-1
正确答案:9.9×10-7或10-6-10-8
②设NO为xmol,NO2为ymol;列方程组:根据氮原子守恒2(x+y)=6① 根据得失电子数相等2×4=2x+4y②;①②联立可得:x=2,y=1,则该工厂尾气中NO和NO2的物质的量比为2:1.
正确答案:2:1


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列各选项中,各类物质依次表示为X、Y、Z,其中与图中三个圆所示的从属关系不相符的是:

A. 氧化物、化合物、纯净物
B. 碱性氧化物、金属氧化物、氧化物
C. 胶体、分散系、混合物
D. 复分解反应、置换反应、化学反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子反应方程式正确的是
A. 实验室用固体氯化铵和熟石灰共热制取NH3:2NH4++Ca(OH)2![]() 2NH3↑+ Ca2++2H2O
2NH3↑+ Ca2++2H2O
B. 铜与浓硝酸反应: 3Cu + 8H+ + 2NO3-=3Cu2+ + 2NO↑ + 4H2O
C. 氨水与FeCl3溶液反应:3OH-+ Fe3+ =Fe(OH)3↓
D. Na2O2投入水中:2Na2O2+2H2O = 4Na++4OH-+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】m g氢气和n g氦气的下列说法中,正确的是
A.同温同压下,H2与He的体积比为m∶2n
B.同温同压下,若m=n,则H2与He的分子数之比为2∶1
C.同温同压下,同体积时,H2与He的质量比![]() >1
>1
D.同温同压下,H2与He的密度比为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年IUPAC命名117号元素为TS(中文名![]() ,tián),TS的原子核外最外层电子数是7.下列说法不正确的是( )
,tián),TS的原子核外最外层电子数是7.下列说法不正确的是( )
A. TS是第七周期第ⅦA族元素 B. TS的同位素原子具有相同的电子数
C. TS在同族元素中非金属性最弱 D. 中子数为176的TS核素符号是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从某废催化剂(含ZnO、CuO、Fe2O3、石墨及MnO2等)中回收金属并制取活性氧化锌的工艺流程如下(已知:Zn及其氧化物、氢氧化物的性质与Al及其相应化合物性质类似):

(1)废催化剂“破碎”的目的是____________________________________________。
(2)“氧化”时Mn2+被氧化的离子方程式为_________________________________。
(3)“中和、沉淀”时,若pH过高,则碱式碳酸锌的产率偏小。写出其反应的离子方程式(任写一个即可):____________________________________________。
(4)测得“粗铜粉”中铜的质量分数的实验步骤如下:
I.准确称取粗铜粉mg,加入足量盐酸和H2O2溶液使其完全溶解。
Ⅱ.将溶液煮沸1~2min,除去过量的H2O2。
Ⅲ.滴入铁掩蔽剂排除Fe3+的干扰。然后加入稍过量的KI溶液(反应:2Cu2++4I-=2CuI↓+I2),再加入几滴淀粉溶液作指示剂,用 c mol ·L-1Na2S2O3标准溶液滴定至蓝色消失(I2+2S2O32-=2I-+S4O62-)且半分钟内不变色,共消耗Na2S2O3标准溶液VmL。
①铜的质量分数为______________________。
②缺少步骤Ⅱ哙会使测得的铜的质量分数___________(填“偏大”、“偏小”、或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家刚刚发现了某种元素的原子,其质量是a g,12C原子的质量是b g,NA是阿伏加德罗常数的值,下列说法正确的是( )
①该原子的摩尔质量是aNA②Wg该原子的物质的量一定是![]() mol③Wg该原子中含有
mol③Wg该原子中含有![]() 个该原子④由已知信息可得:NA=
个该原子④由已知信息可得:NA=![]()
A.①②B.③④C.②③D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国成功研制的新型可充电 AGDIB电池(铝-石墨双离子电池)采用石墨、铝锂合金作为电极材料,以常规锂盐和碳酸酯溶剂为电解液。电池反应为:CxPF6+LiyAl=Cx+LiPE6+Liy-1Al。放电过程如图,下列说法正确的是

A. B为负极,放电时铝失电子
B. 充电时,与外加电源负极相连一端电极反应为:LiyAl-e-=Li++Liy-1Al
C. 充电时A电极反应式为Cx+PF6-﹣e-=CxPF6
D. 废旧 AGDIB电池进行“放电处理”时,若转移lmol电子,石墨电极上可回收7gLi
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为检验溶液中是否含有常见的四种无机离子,进行了下图所示的实验操作。其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝。由该实验能得到的正确结论是( )
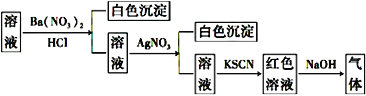
A. 原溶液中一定含有SO42-B. 原溶液中一定含有NH4+
C. 原溶液中一定含有Cl-D. 原溶液中一定含有Fe3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com