
���� ��1��ϡ�����ͭ�ܷ�����Ӧ����������ͭ��һ�����������ˮ����ʽΪ3Cu+8HNO3�T3Cu��NO3��2+2NO��+4H2O��CuԪ�صĻ��ϼ����ߣ�NԪ�صĻ��ϼ۽��ͣ��÷�Ӧת��6e-���Դ������
��2���ٸ����ܶ�Ϊ1.08g/mL��HNO3����������Ϊ12%���c=$\frac{1000��w}{M}$����ϡ��������ʵ���Ũ�ȣ�
�ڸ��ݲ����˱�״����0.56L��һ���������㱻��ԭ��HNO3�����ʵ�����
��� �⣺��1��ϡ�����ͭ�ܷ�����Ӧ����������ͭ��һ�����������ˮ����ʽΪ3Cu+8HNO3�T3Cu��NO3��2+2NO��+4H2O���÷�Ӧ�в���NԪ�ػ��ϼ���+5�۱�Ϊ+2�ۣ���������ΪHNO3����Ӧ��ԭ����ΪNO��CuԪ�ػ��ϼ���0�۱�Ϊ+2�ۣ���ԭ��ΪCu���÷�Ӧת��6e-����˫���ű���÷�Ӧ����ת�Ƶķ������ĿΪ ������˫���ŷ������Ӧ�е���ת�Ƶķ������ĿΪ��
������˫���ŷ������Ӧ�е���ת�Ƶķ������ĿΪ�� ��
��
��2������Ϊ�ܶ�Ϊ1.08g/mL��HNO3����������Ϊ12%������c=$\frac{1000��w}{M}$=$\frac{1000��1.08��12%}{63}$=2.1mol/L���𣺸�ϡ��������ʵ���Ũ��Ϊ2.1mol/L��
���ַ���ʽ3Cu+8HNO3�T3Cu��NO3��2+2NO��+4H2O�������˱�״����0.56L��һ�����������Ա���ԭ��HNO3�����ʵ���������һ���������� 0$\frac{0.56L}{22.4L/mol}$=0.025mol���𣺱���ԭ��HNO3�����ʵ���0.025mol��
���� ���⿼�黯ѧ����ʽ���йؼ��㣬Ϊ��Ƶ���㣬���ؿ���ѧ�����������������ѵ����������ʵ���Ũ�ȼ��㣮



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CO2�� | B�� | O2 | C�� | N2 | D�� | CH4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 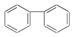 | B�� |  | C�� | 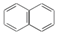 | D�� | 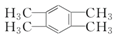 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Na+��Fe2+��NO3-��Cl- | B�� | Na+��K+��NO3-��Cl- | ||
| C�� | Na+��K+��AlO2-��Cl- | D�� | NH4+��K+��SO42-��HCO3- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �÷�Ӧ�Ƿ��ȷ�Ӧ�������¶Ƚ����̷�Ӧ�ﵽƽ���ʱ�� | |
| B�� | ����Ӧ��ϵ��ѹǿ����Ӧ����һ������ | |
| C�� | ����Ӵ��ҵ�SO2�Ϳ���������о������Ҹ÷�Ӧ����Ҫ�ڸ�ѹ�½��� | |
| D�� | ����V2O5������÷�Ӧ������Ӧ���ʶ����ı��淴Ӧ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ϡ��Һ�У�H+��aq��+OH-��aq���TH2O��l����H=-57.3 kJ/mol��������0.6mol H2SO4��ϡ�����뺬1mol NaOH��ϡ��Һ��ϣ��ų�����������57.3 kJ | |
| B�� | ��֪�����飨g�����춡�飨g����H��0������������춡���ȶ� | |
| C�� | 2H2��g��+O2��g���T2H2O��l����H=-571.6kJ•mol-1����H2��ȼ����Ϊ571.6 kJ•mol-1 | |
| D�� | ��֪2C��s��+2O2��g���T2CO2��g����H1��2C��s��+O2��g���T2CO��g����H2�����H1����H2 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com