
【题目】按要求写出下列化学方程式或离子方程式:
(1)硫酸酸化的高锰酸钾与草酸反应的化学方程式:_____________________________。
(2)硫代硫酸钠与稀硫酸反应的化学方程式:____________________________________。
(3)硫酸酸化的碘化钾溶液与氧气反应的离子方程式:________________________。
(4)K2Cr2O7的溶液中K2Cr2O7与K2CrO4转化的离子方程式:____________________。
【答案】2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2ONa2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O4H++4I-+O2=2I2+2H2OCr2O72-+H2O![]() 2CrO42-+2H+
2CrO42-+2H+
【解析】
(1)草酸具有还原性,被酸性高锰酸钾氧化成二氧化碳,高锰酸钾还原成Mn2+;(2)硫代硫酸根离子和酸反应生成硫单质和二氧化硫气体;(3)碘化钾具有还原性,酸性条件下可被氧气氧化为单质碘;(4)K2Cr2O7溶液中存在如下平衡:Cr2O72-+H2O![]() 2CrO42-+2H+。
2CrO42-+2H+。
(1)酸性条件下,酸化的高锰酸钾与草酸发生氧化还原反应,生成锰离子、二氧化碳、水,该离子反应为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O;(2)硫代硫酸钠与稀硫酸发生歧化反应,生成S、二氧化硫、水,反应的离子反应为:S2O32-+2H+=S↓+SO2↑+H2O;(3)硫酸酸化的碘化钾淀粉溶液中的碘离子会被氧气氧化为碘单质,遇淀粉溶液呈蓝色,反应的离子方程式为:4H++4I-+O2=2I2+2H2O;(4)在水溶液中,橙红色的Cr2O72-与黄色的CrO42-存在转化平衡,转化的离子方程式为:Cr2O72-+H2O![]() 2CrO42-+2H+。
2CrO42-+2H+。


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】已知可逆反应aA+bB![]() cC中,5分钟时分别测得在不同温度下物质的含量A%和C%,绘制变化曲线如图所示,下列说法正确的是( )
cC中,5分钟时分别测得在不同温度下物质的含量A%和C%,绘制变化曲线如图所示,下列说法正确的是( )

A. 该反应在T1、T3温度时达到过化学平衡
B. 该反应在T2温度时达到过化学平衡
C. 该反应的逆反应是放热反应
D. 升高温度,平衡会向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质转化关系的说法中不正确的是

A. 图1中甲可能是Fe,X可能是Cl2
B. 图2中A可能为F2,C可能为O2
C. 图2中A可能为Ca(OH)2,C可能为NaOH
D. 图3中a可能为C,b可能为CO,c可能为CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于敞口容器中的化学反应:Zn(s)+H2SO4(aq)===ZnSO4(aq)+H2(g),下列叙述中不正确的是( )

A. Zn和H2SO4的总能量大于ZnSO4和H2的总能量
B. 反应过程中能量关系可用上图表示
C. 若将该反应设计成原电池,则Zn为负极
D. 若将该反应设计成原电池,当有32.5g锌溶解时正极放出11.2 L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图装置可以进行实验并能达到实验目的的是
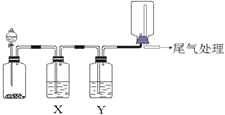
选项 | 实验目的 | X中试剂 | Y中试剂 |
A[] | 用MnO2和浓盐酸制取并收集纯净干燥的Cl2 | 饱和食盐水 | 浓硫酸 |
B | 用Cu与稀硝酸制取并收集纯净干燥的NO | 水 | 浓硫酸 |
C | 验证电石与饱和食盐水反应生成的气体的性质并收集 | CuSO4溶液 | KMnO4 |
D | CaCO3和稀盐酸制取并收集纯净干燥的CO2 | 饱和NaHCO3溶液 | 浓硫酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下,在密闭容器中用H2还原WO3可得到金属钨,其总反应为:WO3 (s) + 3H2 (g) ![]() W (s) + 3H2O (g) 请回答下列问题:
W (s) + 3H2O (g) 请回答下列问题:
(1)上述反应的化学平衡常数表达式为___________________________。
(2) 某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为_______;随温度的升高,H2与水蒸气的体积比减小,则该反应为___________反应(填“吸热”或“放热”)。
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
温度 | 25℃ 550℃ 600℃ 700℃ |
主要成份 | WO3 W2O5 WO2 W |
第一阶段反应的化学方程式为________;580℃时,固体物质的主要成分为________;假设WO3完全转化为W,则三个阶段消耗H2物质的量之比为__________________。
(4)已知:温度过高时,WO2 (s)转变为WO2 (g);
WO2 (s) + 2H2 (g) ![]() W (s) + 2H2O (g);ΔH = +66.0 kJ·mol-1
W (s) + 2H2O (g);ΔH = +66.0 kJ·mol-1
WO2 (g) + 2H2 ![]() W (s) + 2H2O (g);ΔH = -137.9 kJ·mol-1
W (s) + 2H2O (g);ΔH = -137.9 kJ·mol-1
则WO2 (s) ![]() WO2 (g) 的ΔH = ______________________。
WO2 (g) 的ΔH = ______________________。
(5)钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W (s) +2I2 (g) ![]() WI4 (g)。下列说法正确的有________。
WI4 (g)。下列说法正确的有________。
a.灯管内的I2可循环使用
b.WI4在灯丝上分解,产生的W又沉积在灯丝上
c.WI4在灯管壁上分解,使灯管的寿命延长
d.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z的原子序数依次增大,在周期表中Y分别与X、Z相邻。回答下列问题:
(1)若X、Y和Z的单质都为金属,Y与Z左右相邻,Z的单质被称为“国防金属”。则Y的单质在O2中燃烧产物中含有的化学键为____________________________。
(2)若X、Y和Z位于同一周期,高纯度Y单质常用于制造太阳能电池。则除去Y的氧化物中所含X氧化物杂质的方法是________________过滤、洗涤、干燥。
(3)若X原子最外层电子数是电子层数的2倍,Z与Y同主族,则X、Y、Z的简单气态氢化物中,沸点最高的是________________。(填化学式)
(4)若Y的原子序数等于X的2倍,T是Z的气态氢化物。
①写出Z2X对应的水化物分子的电子式________________。
②M是短周期中原子半径最大的元素,由M、X、Y元素组成的一种化合物与T的水溶液反应产生刺激性气味的气体,溶液变浑浊。写出反应的离子方程式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.有甲、乙、丙三种物质:
甲![]() 乙
乙 ![]()
分子式 | C9H8O |
部分性质 | 能使Br2/CCl4褪色 |
丙
(1)乙中含有的官能团的名称为_______________;
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):
![]()
其中反应II的条件是___,反应III的化学方程式为______(不需注明反应条件);
(3)由甲出发合成丙的路线之一如下:

(a)写出反应③化学方程式________;
(b)丙的结构简式为_______________;
(c)D有多种同分异构体,任写其中一种能同时满足下列条件的异构体结构简式_______。
a.苯环上的一氯代物有两种
b.在空气中易被氧化,遇FeCl3溶液显紫色
c.能与Br2/CCl4发生加成反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com