
【题目】苯甲醛是一种重要的化工原料,某小组同学利用如图所示实验装置(夹持装置已略去)制备苯甲醛。已知有机物的相关数据如下表所示:
有机物 | 沸点℃ | 密度为g/cm3 | 相对分子 质量 | 溶解性 |
苯甲醛 | 178.1 | 1.045 | 106 | 微溶于水,易溶于乙醇、醚和卤代烃 |
苯甲醇 | 205.7 | 1.045 | 108 | 微溶于水,易溶于乙醇、醚和卤代烃 |
二氯甲烷 | 39.8 | 1.33 | 难溶于水,易溶于有机溶剂 |

实验步骤:
①向容积为500mL的三颈烧瓶加入90.0mL质量分数为5%的次氯酸钠溶液(稍过量),调节溶液的pH为9~10后,加入3.1mL(约3.24g)苯甲醇、75.0mL二氯甲烷,不断搅拌。
②充分反应后,用二氯甲烷萃取水相3次,并将有机相合并。
③向所得有机相中加入无水硫酸镁,过滤,得到有机混合物。
④蒸馏有机混合物,得到1.908g苯甲醛产品。
请回答下列问题:
(1)仪器b的名称为______,搅拌器的作用是______。
(2)苯甲醇与NaClO反应的化学方程式为_______。
(3)步骤①中,投料时,次氯酸钠不能过量太多,原因是____;步骤③中加入无水硫酸镁,若省略该操作, 可能造成的后果是______。
(4)步骤②中,应选用的实验装置是___(填序号)。


(5)步骤④中,蒸馏温度应控制在_______左右。
(6)本实验中,苯甲醛的产率为________(保留到小数点后一位)。
【答案】球形冷凝管 使物质充分混合 ![]() + NaClO→
+ NaClO→![]() + NaCl+H2O 防止苯甲醛被氧化为苯甲酸,使产品的纯度降低 产品中混有水,纯度降低 ③ 178.1℃ 60.0%
+ NaCl+H2O 防止苯甲醛被氧化为苯甲酸,使产品的纯度降低 产品中混有水,纯度降低 ③ 178.1℃ 60.0%
【解析】
苯甲醇与稍过量的次氯酸钠溶液反应生成苯甲醛、氯化钠和水,反应过程中不断搅拌使其充分反应,反应后利用苯甲醛微溶于水,易溶于有机物的性质,用二氯甲烷萃取水相中的苯甲醛等有机物,合并后用无水硫酸镁干燥,得到有机混合物,再蒸馏得到苯甲醛。
⑴根据实验装置得出仪器b的名称为球形冷凝管,搅拌器的作用是使物质充分混合;故答案为:球形冷凝管;使物质充分混合。
⑵苯甲醇与NaClO反应生成苯甲醛、氯化钠和水,其反应的化学方程式为![]() + NaClO→
+ NaClO→![]() + NaCl+H2O;故答案为:
+ NaCl+H2O;故答案为:![]() + NaClO→
+ NaClO→![]() + NaCl+H2O。
+ NaCl+H2O。
⑶步骤①中,投料时,次氯酸钠具有强氧化性,易将苯甲醛氧化,因此次氯酸钠不能过量太多,原因是防止苯甲醛被氧化为苯甲酸,使产品的纯度降低;步骤③中加入无水硫酸镁主要作用是吸收水份,干燥有机物,若省略该操作,可能造成的后果是产品中混有水,纯度降低;故答案为:防止苯甲醛被氧化为苯甲酸,使产品的纯度降低;产品中混有水,纯度降低。
⑷步骤②中,用二氯甲烷萃取水相中的有机物,溶液分层,用分液漏斗分离;故答案为:③。
⑸步骤④中,根据题意苯甲醛的178.1℃,因此蒸馏温度应控制在178.1℃左右;故答案为:178.1℃。
⑹根据![]() ~
~ ![]() 关系式,3.24g苯甲醇上得到苯甲醛的质量为
关系式,3.24g苯甲醇上得到苯甲醛的质量为![]() ,苯甲醛的产率为
,苯甲醛的产率为![]() ;故答案为:60.0%。
;故答案为:60.0%。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】不能正确表示下列变化的离子方程式是
A.二氧化硫与酸性高锰酸钾溶液反应:5SO2+2H2O+2MnO4-===2Mn2++5SO42-+4H+
B.FeCl3溶液腐蚀铜板:2Fe3++Cu===2Fe2++Cu2+
C.苯酚钠溶液中通入少量CO2:2![]() +CO2+H2O====2
+CO2+H2O====2![]() +CO32-
+CO32-
D.酸性碘化钾溶液中滴加适量双氧水:2I+2H++H2O2===I2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有四种元素的基态原子的电子排布式:
① ![]() ;②
;② ![]() ;③
;③ ![]() ;④
;④ ![]() 。
。
则下列有关比较中正确的是( )
A.第一电离能:④>③>②>①
B.原子半径:④>③>②>①
C.电负性:④>③>②>①
D.最高正化合价:④>③=②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定。
(1)实验中应选用___作指示剂。
(2)用标准的NaOH溶液滴定待测的白醋时,如何判断滴定终点:___。
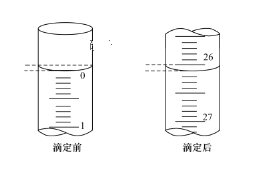
(3)第一次滴定前后,碱式滴定管中的液面位置如图所示,则V标=__mL。
(4)下列有关中和滴定的操作:①用标准液润洗滴定管;②往滴定管内注入标准溶液;③检查滴定管是否漏水;④滴定;⑤滴加指示剂于待测液;⑥洗涤。
正确的操作顺序是____
A.⑤④③②①⑥ B.⑤①②⑥④③
C.③⑥①②⑤④ D.③⑥①②④⑤
(5)滴定过程中进行如下操作,分别指出该项操作对滴定结果的影响(填“偏高”、“偏低”或“无影响”)
Ⅰ.滴定前未用标准液润洗碱式滴定管___;
Ⅱ.滴定结束时俯视滴定管刻度___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如图所示装置制取少量溴苯![]() 已知该反应为放热反应
已知该反应为放热反应![]() ,下列说法不正确的是( )
,下列说法不正确的是( )
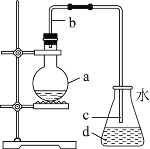
A.加入烧瓶a中试剂是苯、液溴和铁屑
B.导管b的作用是导气和冷凝回流
C.锥形瓶内可以观察到白雾,这是因为生成的HBr结合空气中的水蒸气
D.实验结束后,向d中滴入AgNO3溶液若有淡黄色沉淀生成,则可以证明苯和液溴发生了取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质M是一种日常生活中不可缺少的调味品。已知C可在D中燃烧发出苍白色火焰。M与其他物质的转化关系如下图所示(部分产物已略去):
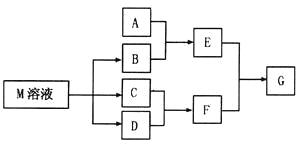
(1)写出用惰性电极电解M溶液的离子方程式_______________________。
(2)若A是一种酸性氧化物,且可用于制造玻璃,则G的化学式是_________________。
(3)若A是一种常见金属单质,且A与B溶液能够反应,则将过量的F溶液逐滴加入E溶液,边加边振荡,所看到的实验现象是_______________。
(4)若A是一种盐,A溶液与B溶液混合产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,则由A转化成E的离子方程式是__________________________________。
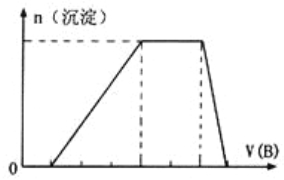
(5)若A是一种溶液,只可能含有![]() 中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图所示。由此可知,该溶液中肯定含有的离子及其浓度之比为_________。
中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图所示。由此可知,该溶液中肯定含有的离子及其浓度之比为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验用所给实验装置可达到目的的是( )

选项 | 反应原理 |
A |
|
B | CH3COOH+(CH3)2CHCH2CH2OH |
C |
|
D | CH3CH2CH2CH2OH |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种用途非常广泛的基础化工原料,可通过下列反应合成:
Ⅰ.CO(g)+2H2(g) ![]() CH3OH(g)△H1
CH3OH(g)△H1
Ⅱ.CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)△H2
CH3OH(g)+H2O(g)△H2
Ⅲ.CO(g)+H2O(g) ![]() CO2(g)+H2(g)△H3
CO2(g)+H2(g)△H3
回答下列问题
(1)反应(Ⅰ)的△S________(填“>”或“<”)0,△H1=________(用△H2、△H3表示)。
(2)上述反应的平衡常数的自然对数值lnKP(KP为以分压表示的平衡常数)与温度的关系如图甲所示
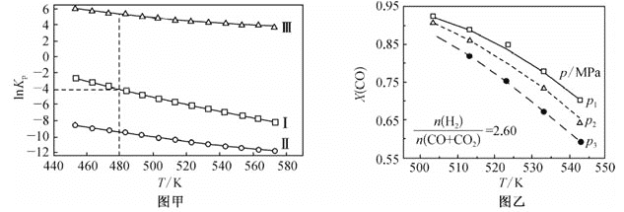
①反应(Ⅱ)的△H________(填“>”或“<”)0。
②480K时,lnKP(Ⅰ)+lnKp(Ⅱ)+lnKp(Ⅲ)=________。
③某温度下,向某恒容密闭容器中充入0.1 molCO和0.2molH2发生反应(Ⅰ),达到平衡时,CO的转化率为90%,若平衡时总压强5MPa,则KP=________(KP为以分压表示的平衡常数,分压=总压×物质的量分数)。
(3)若用CO和CO2混合气体合成甲醇,起始时均控制 ![]() =2.60,CO的平衡转化率X(CO)与温度及压强的关系如图乙所示。下列说法正确的是_____(填字母)。
=2.60,CO的平衡转化率X(CO)与温度及压强的关系如图乙所示。下列说法正确的是_____(填字母)。
A p1<p2<p3
B 升高温度,反应速率和X(CO)均减小
C 起始时若p2=7.2MPa,则H2的分压为5.2MPa
D 其他条件不变,增大 ![]() ,X(CO)增大
,X(CO)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对已经达到平衡的下列体系,只改变一个条件,对平衡移动的方向判断错误的是
A.CaCO3(s) ![]() CaO(s) +CO2(g),减小CO2浓度,平衡正反应方向移动
CaO(s) +CO2(g),减小CO2浓度,平衡正反应方向移动
B.4NH3(g) +5O2(g) ![]() 4NO(g) +6H2O(g):增大压强,平衡向逆反应方向移动
4NO(g) +6H2O(g):增大压强,平衡向逆反应方向移动
C.HS- + H2O ![]() H3O + S2- ,加水稀释,平衡向逆反应方向移动
H3O + S2- ,加水稀释,平衡向逆反应方向移动
D.H2(g) + I2(g) ![]() 2HI(g) :扩大容器体积,平衡不移动
2HI(g) :扩大容器体积,平衡不移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com