
【题目】不能正确表示下列变化的离子方程式是
A.二氧化硫与酸性高锰酸钾溶液反应:5SO2+2H2O+2MnO4-===2Mn2++5SO42-+4H+
B.FeCl3溶液腐蚀铜板:2Fe3++Cu===2Fe2++Cu2+
C.苯酚钠溶液中通入少量CO2:2![]() +CO2+H2O====2
+CO2+H2O====2![]() +CO32-
+CO32-
D.酸性碘化钾溶液中滴加适量双氧水:2I+2H++H2O2===I2+2H2O
【答案】C
【解析】
A.二氧化硫与酸性高锰酸钾溶液反应,SO2中硫元素由+4价失2e-到+6价,体现还原性,KMnO4中锰元素由+7价得5e-到+2价,体现氧化性,在氧化还原反应中,根据得失电子相等,配平方程式,其离子方程式为:5SO2+2H2O+2MnO4-═2Mn2++5SO42-+4H+,故A正确;
B.FeCl3溶液腐蚀铜板,由于Fe3+的氧化性较强,会与Cu反应,生成氯化亚铁和氯化铜,该反应的离子方程式为:2Fe3++Cu═2Fe2++Cu2+,故B正确;
C.由于酸性H2CO3>C6H5OH>HCO3-,所以苯酚钠通入二氧化碳生成苯酚和碳酸氢钠,反应的离子方程式为:![]() +CO2+H2O→
+CO2+H2O→![]() +HCO3-,故C错误;
+HCO3-,故C错误;
D.酸性碘化钾溶液中滴加适量的双氧水,双氧水会将碘离子氧化成碘单质,发生反应的离子方程式为:2I-+2H++H2O2═I2+2H2O,故D正确;
答案为C。


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
【题目】断肠草(Gelsemium)为中国古代九大毒药之一,据记载能“见血封喉”,现代查明它是葫蔓藤科植物葫蔓藤,其中的毒素很多,下列是分离出来的四种毒素的结构简式,下列推断正确的是( )
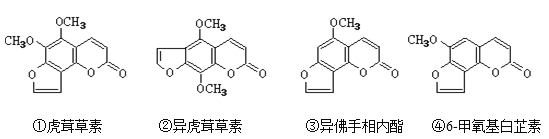
A.②中所含官能团种类比③中多
B.①、④互为同系物
C.①、②、③、④均能与氢氧化钠溶液反应
D.等物质的量②、③分别在足量氧气中完全燃烧,前者消耗氧气比后者少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备硝基苯的实验装置如图所示(夹持装置已略去)。下列说法不正确的是

A.水浴加热的优点是使反应物受热均匀、容易控制温度
B.反应完全后,可用仪器a、b蒸馏得到产品
C.实验过程中若发现仪器b中未加入碎瓷片,可冷却后补加
D.将浓硫酸、浓硝酸和苯混合时,应向浓硝酸中加入浓硫酸, 待冷却至室温后,将所得混合物加入苯中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用含锌废渣(主要含Zn以及少量S、Fe、Mn、Cd等)制取氧化锌(ZnO)的工艺流程如图
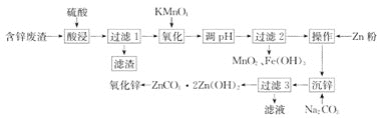
回答下列问题:
(1)“酸浸”时,锌、铁的浸出率如图(a)所示,应控制浸取终点的pH为________。
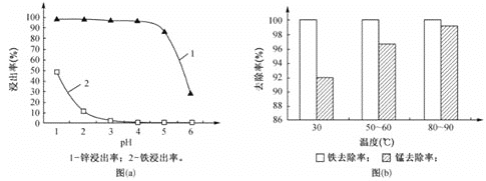
(2)“氧化”时,Fe2+、Mn2+去除率与温度的关系如图(b)所示,相同条件下还原性较强的是________(填“Fe2+”或“Mn2+”),Fe2+被KMnO4氧化生成Fe3+和MnO2的离子方程式为________。
(3)加Zn粉“操作”的目的是________。
(4)“沉锌”的离子方程式为________,由碱式碳酸锌制备轻质氧化锌的方法是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液一定呈中性的是:
A.pH=7的溶液B.Kw=1.0×10-14的溶液
C.c2(OH-)=KwD.pH=3的酸与pH=11的碱等体积混合后的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于平衡常数的说法正确的是:
A.K不变,平衡可能移动
B.同一个反应的化学计量数增大2倍,K值也增大两倍
C.K值越大,反应速率也越快
D.对于合成氨反应,压强增大,平衡右移,K增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时醋酸的电离常数为1.6×10-5,该温度下向20 mL 0.01 mol·L-1醋酸溶液中不断滴入0.01 mol·L1 NaOH(aq),溶液pH变化如图所示。此过程溶液中离子浓度的关系错误的是
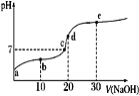
A. a点溶液的c(H+)=4×10-4mol·L-1
B. 水电离程度:e>d>c>b>a
C. b点:2c(Na+)=c(CH3COO-)+c(CH3COOH)
D. d点:c(OH-)=c(CH3COOH)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1mol/L NaOH溶液滴定20mL 0.1mol/L CH3COOH溶液的滴定曲线如图。下列说法错误的是:

A.点①所示溶液中:c(CH3COO-)>c(CH3COOH)>c(Na+)>c(H+)>c(OH-)
B.点②所示溶液中:c(Na+)=c(CH3COO-)>c(H+)=c(OH-)
C.点①②③所示溶液中,均成立:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
D.点③表示整个滴定过程恰好达到滴定终点,在过程中溶液中![]() 始终不变
始终不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲醛是一种重要的化工原料,某小组同学利用如图所示实验装置(夹持装置已略去)制备苯甲醛。已知有机物的相关数据如下表所示:
有机物 | 沸点℃ | 密度为g/cm3 | 相对分子 质量 | 溶解性 |
苯甲醛 | 178.1 | 1.045 | 106 | 微溶于水,易溶于乙醇、醚和卤代烃 |
苯甲醇 | 205.7 | 1.045 | 108 | 微溶于水,易溶于乙醇、醚和卤代烃 |
二氯甲烷 | 39.8 | 1.33 | 难溶于水,易溶于有机溶剂 |

实验步骤:
①向容积为500mL的三颈烧瓶加入90.0mL质量分数为5%的次氯酸钠溶液(稍过量),调节溶液的pH为9~10后,加入3.1mL(约3.24g)苯甲醇、75.0mL二氯甲烷,不断搅拌。
②充分反应后,用二氯甲烷萃取水相3次,并将有机相合并。
③向所得有机相中加入无水硫酸镁,过滤,得到有机混合物。
④蒸馏有机混合物,得到1.908g苯甲醛产品。
请回答下列问题:
(1)仪器b的名称为______,搅拌器的作用是______。
(2)苯甲醇与NaClO反应的化学方程式为_______。
(3)步骤①中,投料时,次氯酸钠不能过量太多,原因是____;步骤③中加入无水硫酸镁,若省略该操作, 可能造成的后果是______。
(4)步骤②中,应选用的实验装置是___(填序号)。


(5)步骤④中,蒸馏温度应控制在_______左右。
(6)本实验中,苯甲醛的产率为________(保留到小数点后一位)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com