
【题目】下列溶液一定呈中性的是:
A.pH=7的溶液B.Kw=1.0×10-14的溶液
C.c2(OH-)=KwD.pH=3的酸与pH=11的碱等体积混合后的溶液
科目:高中化学 来源: 题型:
【题目】
研究发现,在CO2低压合成甲醇反应(CO2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
(1)Co基态原子核外电子排布式为_____________。元素Mn与O中,第一电离能较大的是_________,基态原子核外未成对电子数较多的是_________________。
(2)CO2和CH3OH分子中C原子的杂化形式分别为__________和__________。
(3)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为_________,原因是______________________________。
(4)硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在________。
(5)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420nm,则r(O2-)为________nm。MnO也属于NaCl型结构,晶胞参数为a' =0.448 nm,则r(Mn2+)为________nm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体积相同的甲、乙两个容器中,分别充有等物质的量的N2和H2,在相同温度下发生合成氨反应,并达到平衡。在这过程中,甲容器为恒容容器,乙容器为恒压容器,若甲容器中H2的转化率为a%,则乙容器中H2的转化率为:
A.等于a%B.大于a%C.小于a%D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2L的密闭容器中,发生反应3A(g)+2B(g)![]() 4C(s)+2D(g),加入4molA和2molB,2min后达到平衡,测得生成1.6mol C,则下列说法正确的是:
4C(s)+2D(g),加入4molA和2molB,2min后达到平衡,测得生成1.6mol C,则下列说法正确的是:
A.该反应的化学平衡常数表达式是K=![]()
B.此时,B的平衡转化率是40%
C.增大该体系的压强,平衡向右移动,化学平衡常数增大
D.若向平衡体系移走部分D,则此时正反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A. 图1表示0.001 mol·L-1盐酸滴定0.001 mol·L-1 NaOH溶液的滴定曲线
B. 图2表示从能量角度考虑,石墨比金刚石稳定
C. 图3表示Al3+与OH-反应时含铝微粒浓度变化曲线,图中a点溶液中含大量Al3+
D. 图4所示图中的阴影部分面积的含义是(v正-v逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不能正确表示下列变化的离子方程式是
A.二氧化硫与酸性高锰酸钾溶液反应:5SO2+2H2O+2MnO4-===2Mn2++5SO42-+4H+
B.FeCl3溶液腐蚀铜板:2Fe3++Cu===2Fe2++Cu2+
C.苯酚钠溶液中通入少量CO2:2![]() +CO2+H2O====2
+CO2+H2O====2![]() +CO32-
+CO32-
D.酸性碘化钾溶液中滴加适量双氧水:2I+2H++H2O2===I2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.强酸、强碱、重金属盐等可使蛋白质变性
B.用新制氢氧化铜悬浊液(必要时可加热)能鉴别甲酸、乙醇、乙醛
C.乙酸乙酯中混有的乙酸,可加入足量的饱和![]() 溶液,经分液除去
溶液,经分液除去
D.向苯和苯酚的混合液中加入浓溴水,充分反应后过滤,可除去苯中少量的苯酚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备1,2-二溴乙烷,可用足量的乙醇先制备乙烯,再用乙烯和少量的溴制备1,2-二溴乙烷,装置如下图所示:
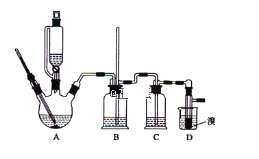
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g · cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)写出由乙醇制备乙烯的化学方程式______________________________,乙烯制备1,2-二溴乙烷的化学方程式_______________________________。
(2)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是___________;(填正确选项前的字母)
a.引发反应 b.加快反应速度
c.防止乙醇挥发 d.减少副产物乙醚生成
(3)在装置A中除了浓硫酸和乙醇外,还应加入_____,其目的是_______装置A中生成副产物乙醚的化学反应方程式 ___________________。
(4)实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的二氧化硫,为了验证二氧化硫的存在并除去二氧化硫对后续反应的干扰,某同学在A和D之间加入了B、C两个装置,其中B和C中可分别盛放 ________________,
a.酸性KMnO4和水 b.品红和NaOH溶液
c.酸性KMnO4和NaOH溶液d.品红和酸性KMnO4
(5)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在_____层(填“上”、“下”);若产物中有少量副产物乙醚。可用_______的方法除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如图所示装置制取少量溴苯![]() 已知该反应为放热反应
已知该反应为放热反应![]() ,下列说法不正确的是( )
,下列说法不正确的是( )
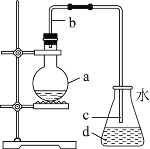
A.加入烧瓶a中试剂是苯、液溴和铁屑
B.导管b的作用是导气和冷凝回流
C.锥形瓶内可以观察到白雾,这是因为生成的HBr结合空气中的水蒸气
D.实验结束后,向d中滴入AgNO3溶液若有淡黄色沉淀生成,则可以证明苯和液溴发生了取代反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com