
【题目】用含锌废渣(主要含Zn以及少量S、Fe、Mn、Cd等)制取氧化锌(ZnO)的工艺流程如图
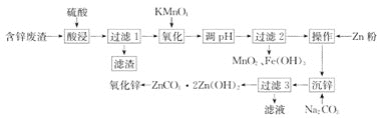
回答下列问题:
(1)“酸浸”时,锌、铁的浸出率如图(a)所示,应控制浸取终点的pH为________。
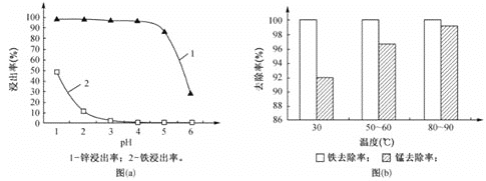
(2)“氧化”时,Fe2+、Mn2+去除率与温度的关系如图(b)所示,相同条件下还原性较强的是________(填“Fe2+”或“Mn2+”),Fe2+被KMnO4氧化生成Fe3+和MnO2的离子方程式为________。
(3)加Zn粉“操作”的目的是________。
(4)“沉锌”的离子方程式为________,由碱式碳酸锌制备轻质氧化锌的方法是________。
【答案】4(填4~5之间数据均给分) Fe2+ 3Fe2++MnO4-+4H+![]() 3Fe3++MnO2↓+2H2O 除去Cd 3Zn2++5CO32-+4H2O=ZnCO3·2Zn(OH)2↓+4HCO3-或3Zn2++3CO32-+2H2O= ZnCO3·2Zn(OH)2↓+2CO2↑ 高温焙烧
3Fe3++MnO2↓+2H2O 除去Cd 3Zn2++5CO32-+4H2O=ZnCO3·2Zn(OH)2↓+4HCO3-或3Zn2++3CO32-+2H2O= ZnCO3·2Zn(OH)2↓+2CO2↑ 高温焙烧
【解析】
(1)“酸浸”过程是为了浸出锌,据此结合图像中锌、铁的浸出率与pH的关系确定答案;
(2)根据氧化时Fe2+和Mn2+去除率的大小分析其还原性强弱;根据得失电子守恒、电荷守恒和原子守恒书写反应的离子方程式;
(3)加锌粉是为了除去Cd;
(4)“沉锌”过程中反应生成ZnCO3·2Zn(OH)2,据此写出反应的离子方程式;由ZnCO3·2Zn(OH)2获得ZnO应通过高温焙烧操作。
(1)此流程是为了制取氧化锌,因此“酸浸”过程中是为了浸出锌,而不浸出铁,由图中锌铁的浸出率可知,当pH在4~5时,锌的浸出率最高,铁的浸出率几乎为0;因此应控制浸取液终点的pH为4~5;
(2)由图b可知,反应过程中,Fe2+的去除率高于Mn2+, 因此说明相同条件下,Fe2+的还原性强于Mn2+;KMnO4将Fe2+氧化为Fe3+,自身还原为MnO2,过程中Mn由+7价变为+4价,得到3个电子,Fe由+2价变为+3价,失去1个电子,根据得失电子守恒可得,Fe2+、Fe3+的系数为3,MnO4-、MnO2的系数为1;由电荷守恒可得,反应物中含有4个H+;由氢原子守恒可得,生成物中含有H2O,且其系数为2;因此可得该反应的离子方程式为:3Fe2++MnO4-+4H+=3Fe3++MnO2↓+2H2O;
(3)加锌粉是为了除去Cd;
(4)“沉锌”过程中反应生成ZnCO3·2Zn(OH)2,该反应的离子方程式为: 3Zn2++5CO32-+4H2O=ZnCO3·2Zn(OH)2↓+4HCO3-或3Zn2++3CO32-+2H2O=ZnCO3·2Zn(OH)2↓+2CO2↑;由于ZnCO3·2Zn(OH)2受热易分解,形成ZnO,因此由碱式碳酸锌制备轻质氧化锌,可采用高温焙烧操作。


 全能测控一本好卷系列答案
全能测控一本好卷系列答案 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A. 图I表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
B. 图Ⅱ表示常温下,0.1000mol·L-1 NaOH溶液滴定20.00mL 0.1000mol·L-1 CH3COOH溶液所得到的滴定曲线
C. 图Ⅲ表示一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化曲线,图中a、b、c三点醋酸的电离程度:a<b<c
D. 图Ⅳ表示反应4CO(g)+2NO2(g ) ![]() N2(g)+4CO2(g) ΔH <0,在其他条件不变的情况下改变起始物CO的物质的量,平衡时N2的体积分数变化情况,由图可知NO2的转化率b>a>c
N2(g)+4CO2(g) ΔH <0,在其他条件不变的情况下改变起始物CO的物质的量,平衡时N2的体积分数变化情况,由图可知NO2的转化率b>a>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外化学兴趣小组欲从铝土矿中提取少量的Al2O3,查阅资料得知,铝土矿的主要成分是Al2O3,杂质是Fe2O3、SiO2等。从铝土矿中提取Al2O3的过程如下:
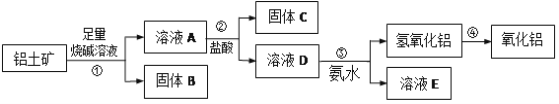
(1)固体B的主要用途为(只写一种即可)______;
(2)第①步,向铝土矿中加入足量烧碱溶液,充分反应。发生反应的离子方程式是:______
(3)第③步的实验操作名称是______,请简述洗涤的操作过程______。若往A溶液中通入足量CO2,产生的沉淀为______(填化学式);
(4)工业上制取AlCl3常用Al2O3与炭、Cl2在高温条件下反应,已知每消耗0.5mol炭单质,转移1mol电子,则该反应的化学方程式为______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各表述与示意图一致的是

A.图①表示25℃时,用0.1mol/L盐酸滴定20mL0.1mol/LNaOH溶液,溶液的pH随加入酸体积的变化得到的滴定曲线
B.图②表示一定条件下进行的反应2SO2(g)+O2(g)![]() 2SO3(g)△H<O各成分的物质的量变化.t2时刻改变的条件可能是降低温度或缩小容器体积
2SO3(g)△H<O各成分的物质的量变化.t2时刻改变的条件可能是降低温度或缩小容器体积
C.图③表示某明矶溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(0H)2溶液体积的关系,在加入20mL溶液时铝离子恰好沉淀完全
D.图④表示化学反应H2(g)+Cl2(g)=2HCl(g)的能量变化,则该反应的反应热△H=+183kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2L的密闭容器中,发生反应3A(g)+2B(g)![]() 4C(s)+2D(g),加入4molA和2molB,2min后达到平衡,测得生成1.6mol C,则下列说法正确的是:
4C(s)+2D(g),加入4molA和2molB,2min后达到平衡,测得生成1.6mol C,则下列说法正确的是:
A.该反应的化学平衡常数表达式是K=![]()
B.此时,B的平衡转化率是40%
C.增大该体系的压强,平衡向右移动,化学平衡常数增大
D.若向平衡体系移走部分D,则此时正反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向浓度均为0.1mol/L、体积均为100mL的两种一元酸HX、HY溶液中分别加入NaOH固体,溶液中lg![]() 随n(NaOH)的变化如下图所示。下列说法不正确的是
随n(NaOH)的变化如下图所示。下列说法不正确的是

A. HX为强酸,HY为弱酸 B. b点时溶液呈中性
C. 水的电离程度:d>c D. c点时溶液的pH=4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不能正确表示下列变化的离子方程式是
A.二氧化硫与酸性高锰酸钾溶液反应:5SO2+2H2O+2MnO4-===2Mn2++5SO42-+4H+
B.FeCl3溶液腐蚀铜板:2Fe3++Cu===2Fe2++Cu2+
C.苯酚钠溶液中通入少量CO2:2![]() +CO2+H2O====2
+CO2+H2O====2![]() +CO32-
+CO32-
D.酸性碘化钾溶液中滴加适量双氧水:2I+2H++H2O2===I2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH3CH2CH2CH2OH→CH3CH2CH2CHO
利用下图装置用正丁醇合成正丁醛。相关数据如下:
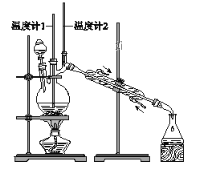
物质 | 沸点/℃ | 密度/(g·cm-3) | 水中溶解性 |
正丁醇 | 117.2 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
下列说法中,不正确的是( )
A. 为防止产物进一步氧化,应将酸化的Na2Cr2O7溶液逐滴加入正丁醇中
B. 向获得的粗正丁醛中加入少量金属钠,检验其中是否含有正丁醇
C. 反应结束,将馏出物倒入分液漏斗中,分去水层,粗正丁醛从分液漏斗上口倒出
D. 当温度计1示数为90~95℃,温度计2示数在76℃左右时,收集产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定。
(1)实验中应选用___作指示剂。
(2)用标准的NaOH溶液滴定待测的白醋时,如何判断滴定终点:___。
(3)第一次滴定前后,碱式滴定管中的液面位置如图所示,则V标=__mL。
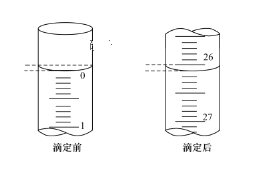
(4)下列有关中和滴定的操作:①用标准液润洗滴定管;②往滴定管内注入标准溶液;③检查滴定管是否漏水;④滴定;⑤滴加指示剂于待测液;⑥洗涤。
正确的操作顺序是____
A.⑤④③②①⑥ B.⑤①②⑥④③
C.③⑥①②⑤④ D.③⑥①②④⑤
(5)滴定过程中进行如下操作,分别指出该项操作对滴定结果的影响(填“偏高”、“偏低”或“无影响”)
Ⅰ.滴定前未用标准液润洗碱式滴定管___;
Ⅱ.滴定结束时俯视滴定管刻度___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com