
ΓΨΧβΡΩΓΩΜ·―ßΖ¥”ΠΥΌ¬ ”κœόΕ»”κ…ζ≤ζΓΔ…ζΜνΟή«–œύΙΊ
Θ®1Θ©A―ß…ζΈΣΝΥΧΫΨΩ–Ω”κ―ΈΥαΖ¥”ΠΙΐ≥Χ÷–ΒΡΥΌ¬ ±δΜ·Θ§Υϊ‘Ύ200mLœΓ―ΈΥα÷–Φ”»κΉψΝΩΒΡ–ΩΖέΘ§”Ο≈≈Υ°Φ·ΤχΖ® ’Φ·Ζ¥”ΠΖ≈≥ωΒΡ«βΤχΘ§ Β―ιΦ«¬Φ»γœ¬Θ®άέΦΤ÷ΒΘ©ΘΚ
±ΦδΘ®minΘ© | 1 | 2 | 3 | 4 | 5 |
«βΤχΧεΜΐΘ®mLΘ©Θ®±ξΉΦΉ¥ΩωΘ© | 100 | 240 | 464 | 576 | 620 |
ΔΌΖ¥”ΠΥΌ¬ Ήν¥σΒΡ ±ΦδΕΈ «Θ®÷Η0ΓΪ1ΓΔ1ΓΪ2ΓΔ2ΓΪ3ΓΔ3ΓΪ4ΓΔ4ΓΪ5 Θ©minΘ§‘≠“ρ « Θ°
ΔΎ«σ2ΓΪ3Ζ÷÷” ±ΦδΕΈ“‘―ΈΥαΒΡ≈®Ε»±δΜ·ά¥±μ ΨΒΡΗΟΖ¥”ΠΥΌ¬ Θ° Θ®…η»ή“ΚΧεΜΐ≤Μ±δΘ©
Θ®2Θ©B―ß…ζ“≤ΉωΆ§―υΒΡ Β―ιΘ§ΒΪ”…”ΎΖ¥”ΠΧΪΩλΘ§≤β≤ΜΉΦ«βΤχΧεΜΐΘ§Ι œκΑλΖ®ΫΒΒΆΖ¥”ΠΥΌ¬ Θ§«κΡψΑοΥϊ―Γ‘ώ‘Ύ―ΈΥα÷–Φ”»κœ¬Ν–“‘Φθ¬ΐΖ¥”ΠΥΌ¬ Θ°Θ®Χν–¥¥ζΚ≈Θ©
A.’τΝσΥ°
B.±υΩι
C.HNO3»ή“Κ
D.CuSO4»ή“Κ
Θ®3Θ©Ρ≥Έ¬Ε»œ¬‘Ύ10LΟή±’»ίΤς÷–Θ§3÷÷ΤχΧ§Έο÷ AΓΔBΓΔCΒΡΈο÷ ΒΡΝΩΥφ ±Φδ±δΜ·«ζœΏ»γΆΦΘ° 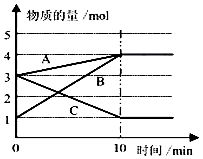
ΔΌΗΟΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ Ϋ « Θ°
ΔΎ«σ‘ΎΗΟΧθΦΰ¥οΒΫΖ¥”ΠΒΡœόΕ»Θ®ΤΫΚβΉ¥Χ§Θ© ±Ζ¥”ΠΈοΒΡΉΣΜ·¬ ΓΨΉΣΜ·¬ = ![]() ΓΝ100%ΓΩΘ§«κ–¥≥ωΦΤΥψΙΐ≥ΧΘ§ΦΤΥψΫαΙϊ±ΘΝτ1ΈΜ–Γ ΐΘ©
ΓΝ100%ΓΩΘ§«κ–¥≥ωΦΤΥψΙΐ≥ΧΘ§ΦΤΥψΫαΙϊ±ΘΝτ1ΈΜ–Γ ΐΘ©
ΓΨ¥πΑΗΓΩ
Θ®1Θ©2ΓΪ3ΘΜ“ρΗΟΖ¥”ΠΖ≈»»Θ§ΥφΉ≈Ζ¥”ΠΘ§»ή“ΚΈ¬Ε»…ΐΗΏΘ§Ι Ζ¥”ΠΥΌ¬ Φ”ΩλΘΜ0.1mol/Θ®L?minΘ©
Θ®2Θ©AB
Θ®3Θ©2C?A+3BΘΜΫβΘΚCΈΣΖ¥”ΠΈοΘ§Τδ≥θ ΦΈο÷ ΒΡΝΩΈΣ3molΘ§ΤΫΚβ ±ΈΣ3molΘ§‘ρCΒΡΉΣΜ·¬ ΈΣΘΚ ![]() ΓΝ100%=66.7%
ΓΝ100%=66.7%
ΓΨΫβΈωΓΩΫβΘΚΘ®1Θ©ΔΌ¥”±μ÷– ΐΨίΩ¥≥ω2 minΓΪ3 min ’Φ·ΒΡ«βΤχ±»ΤδΥϊ ±ΦδΕΈΕύΘ§Υδ»ΜΖ¥”Π÷–cΘ®H+Θ©œ¬ΫΒΘ§ΒΪ÷ς“Σ‘≠“ρ «Zn÷ΟΜΜH2ΒΡΖ¥”Π «Ζ≈»»Ζ¥”ΠΘ§Έ¬Ε»…ΐΗΏΘ§Υυ“‘¥πΑΗ «ΘΚ2ΓΪ3ΘΜ“ρΗΟΖ¥”ΠΖ≈»»Θ§ΥφΉ≈Ζ¥”ΠΘ§»ή“ΚΈ¬Ε»…ΐΗΏΘ§Ι Ζ¥”ΠΥΌ¬ Φ”ΩλΘΜΔΎ‘Ύ2ΓΪ3min ±ΦδΕΈΡΎΘ§…ζ≥…±ξΩωœ¬«βΤχΒΡΧεΜΐΈΣΘΚ232mL©¹120mL=112mLΘ§nΘ®H2Θ©=0.005molΘ§”…2HClΓΪH2Ω…÷ΣΘΚœϊΚΡ―ΈΥαΒΡΈο÷ ΒΡΝΩΈΣ0.01molΘ§ ‘ρΠ‘Θ®HClΘ©= ![]() =0.1 mol/Θ®LminΘ©Θ§
=0.1 mol/Θ®LminΘ©Θ§
Υυ“‘¥πΑΗ «ΘΚ0.1 mol/Θ®LminΘ©ΘΜΘ®2Θ©AΘ°Φ”»κ’τΝσΥ°Θ§»ή“ΚΒΡ≈®Ε»Φθ–ΓΘ§Ζ¥”ΠΥΌ¬ Φθ–ΓΘ§H+ΒΡΈο÷ ΒΡΝΩ≤Μ±δΘ§…ζ≥…«βΤχΒΡΝΩ“≤≤Μ±δΘ§¬ζΉψΧθΦΰΘ§Ι A’ΐ»ΖΘΜ
BΘ°Φ”»κ±υΩιΚσΈ¬Ε»ΫΒΒΆΘ§Ζ¥”ΠΥΌ¬ Φθ–ΓΘ§H+ΒΡΈο÷ ΒΡΝΩ≤Μ±δΘ§…ζ≥…«βΤχΒΡΝΩ“≤≤Μ±δΘ§¬ζΉψΧθΦΰΘ§Ι B’ΐ»ΖΘΜ
CΘ°Φ”»κHNO3»ή“ΚΘ§œθΥαΨΏ”–«Ω―θΜ·–‘Θ§”κΫπ τΖ¥”Π…ζ≥…NOΘ§≤ΜΜα…ζ≥…«βΤχΘ§Ι C¥μΈσΘΜ
DΘ°Φ”»κCuSO4»ή“ΚΘ§–Ω”κΆ≠άκΉ”Ζ¥”Π…ζ≥…Ά≠Θ§ΙΙ≥…Ά≠–Ω‘≠Βγ≥ΊΘ§Φ”ΩλΝΥΖ¥”ΠΥΌ¬ Θ§Ι D¥μΈσΘΜΥυ“‘¥πΑΗ «ΘΚABΘΜΘ®3Θ©ΔΌ”…ΆΦœσΩ…“‘Ω¥≥ωΘ§Ζ¥”Π÷–AΓΔBΒΡΈο÷ ΒΡΝΩ‘ωΦ”Θ§CΒΡΈο÷ ΒΡΝΩΦθ…ΌΘ§‘ρAΓΔBΈΣ…ζ≥…ΈοΘ§CΈΣΖ¥”ΠΈοΘ§«“ΓςnΘ®AΘ©ΘΚΓςnΘ®BΘ©ΘΚΓςnΘ®CΘ©=1molΘΚ3molΘΚ2mol=1ΘΚ3ΘΚ2Θ§‘ρΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣΘΚ2CA+3BΘ§
Υυ“‘¥πΑΗ «ΘΚ2CA+3BΘΜ
ΔΎCΈΣΖ¥”ΠΈοΘ§Τδ≥θ ΦΈο÷ ΒΡΝΩΈΣ3molΘ§ΤΫΚβ ±ΈΣ3molΘ§‘ρCΒΡΉΣΜ·¬ ΈΣΘΚ ![]() ΓΝ100%=66.7%Θ§
ΓΝ100%=66.7%Θ§
¥πΘΚΗΟΧθΦΰ¥οΒΫΖ¥”ΠΒΡœόΕ»Θ®ΤΫΚβΉ¥Χ§Θ© ±Ζ¥”ΠΈοΒΡΉΣΜ·¬ ΈΣ66.7%Θ°


 ΒΎ1ΨμΒΞ‘Σ‘¬ΩΦΤΎ÷–ΤΎΡ©œΒΝ–¥πΑΗ
ΒΎ1ΨμΒΞ‘Σ‘¬ΩΦΤΎ÷–ΤΎΡ©œΒΝ–¥πΑΗ
| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœύΆ§≤Ρ÷ ΒΡΧζ‘ΎΆΦ÷–ΒΡΥΡ÷÷«ιΩωœ¬Ήν≤Μ“Ή±ΜΗ· ¥ΒΡ «Θ® Θ©
A.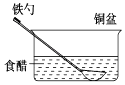
B.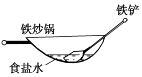
C.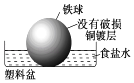
D.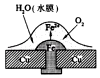
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ¬ΝΚΆ«β―θΜ·ΦΊΕΦ «÷Ί“ΣΒΡΙΛ“Β≤ζΤΖΓΘ«κΜΊ¥πΘΚ
Θ®1Θ©ΙΛ“Β“±ΝΕ¬ΝΒΡΜ·―ßΖΫ≥Χ Ϋ « ΘΜ¬Ν”κ«β―θΜ·ΦΊ»ή“ΚΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ Ϋ « ΓΘ
Θ®2Θ©ΙΛ“ΒΤΖ«β―θΜ·ΦΊΒΡ»ή“Κ÷–Κ§”–Ρ≥–©Κ§―θΥα‘”÷ Θ§Ω…”ΟάκΉ”ΫΜΜΜΡΛΖ®ΒγΫβΧα¥ΩΓΘΒγΫβ≤έΡΎΉΑ”–―τάκΉ”ΫΜΜΜΡΛ(÷Μ‘ –μ―τάκΉ”Ά®Ιΐ)Θ§ΤδΙΛΉς‘≠άμ»γΆΦΥυ ΨΓΘ
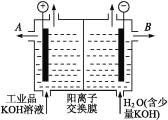
ΔΌΗΟΒγΫβ≤έΒΡ―τΦΪΖ¥”Π Ϋ « ΓΘ
ΔΎΆ®ΒγΩΣ ΦΚσΘ§“θΦΪΗΫΫϋ»ή“ΚpHΜα‘ω¥σΘ§«κΦρ ω‘≠“ρ ΓΘ
Δέ≥ΐ»Ξ‘”÷ ΚσΒΡ«β―θΜ·ΦΊ»ή“Κ¥”»ή“Κ≥ωΩΎ (Χν–¥ΓΑAΓ±ΜρΓΑBΓ±)ΒΦ≥ωΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ¬»Τχ «“Μ÷÷÷Ί“ΣΒΡΙΛ“Β‘≠ΝœΘ§ΙΛ“Β…œάϊ”ΟΖ¥”Π3Cl2+8NH3=N2+6NH4ClΦλ≤鬻ΤχΙήΒά «Ζώ¬©ΤχΘ§œ¬Ν–ΥΒΖ®¥μΈσΒΡ «Θ® Θ©
A.»τΙήΒά¬©Τχ”ωΑ±ΨΆΜα≤ζ…ζΑΉ―Χ
B.ΗΟΖ¥”Πάϊ”ΟΝΥCl2ΒΡ«Ω―θΜ·–‘
C.ΗΟΖ¥”ΠNH3±ΜΜΙ‘≠
D.…ζ≥…1molN2”–6molΒγΉ”ΉΣ“Τ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΡ≥―–ΨΩ–ΓΉι“‘ΧΰAΈΣ÷ς“Σ‘≠ΝœΘ§≤…”Ο“‘œ¬¬ΖœΏΚœ≥…“©ΈοXΚΆΗΏΨέΈοYΘΚ

“―÷ΣΘΚ
«κΜΊ¥πœ¬Ν–Έ ΧβΘΚ
Θ®1Θ©XΒΡΖ÷Ή” «ΈΣ_____Θ§X÷–ΒΡΚ§―θΙΌΡήΆ≈”–_____________Θ®ΧνΟϊ≥ΤΘ©ΓΘ
Θ®2Θ©»τΖ¥”ΠΔΌΓΔΖ¥”ΠΔΎΒΡ‘≠Ή”άϊ”Ο¬ ΨυΈΣ100%ΓΘ‘ρAΒΡΟϊ≥ΤΈΣ_______ΓΘ
Θ®3Θ©EΒΡΫαΙΙΦρ ΫΈΣ_______Θ§Ζ¥”ΠΔέΒΡΧθΦΰΈΣ______Θ§Ζ¥”ΠΔίΒΡΖ¥”Πάύ–Ά «_______ΓΘ
Θ®4Θ©–¥≥ωΖ¥”ΠΔήΒΡΜ·―ßΖΫ≥Χ ΫΘΚ_______ΓΘ
Θ®5Θ©–¥≥ωΖϊΚœœ¬Ν–ΧθΦΰΒΡEΒΡΥυ”–Ά§Ζ÷“λΙΙΧεΒΡΫαΙΙΦρ Ϋ_______ΓΘ
ΔΌ τ”ΎΖ”άύΜ·ΚœΈοΘ§«“ «±ΫΒΡΕ‘ΈΜΕΰ‘Σ»Γ¥ζΈοΘΜ ΔΎΡήΖΔ…ζ“χΨΒΖ¥”ΠΚΆΥ°ΫβΖ¥”ΠΓΘ
Θ®6Θ©“‘CH3CHOΈΣΤπ Φ‘≠ΝœΚœ≥…ZΒΡœΏ¬ΖΘ®ΈόΜζ ‘ΦΝΦΑ»ήΦΝ»Έ―ΓΘ©ΘΚ_______ΓΘ
Κœ≥…¬ΖœΏΒΡ ι–¥Ηώ Ϋ≤Έ’’»γœ¬ ΨάΐΝς≥ΧΆΦΘΚ”…““¥ΦΚœ≥…““œ©ΒΡΖ¥”ΠΝς≥ΧΆΦΩ…±μ ΨΈΣCH3CH2OH![]() CH2=CH2
CH2=CH2![]()
![]() ΓΘ
ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΤ’ΖΞΥϊΆΓ «“Μ÷÷ΒςΫΎ―Σ÷§ΒΡ“©ΈοΘ§ΤδΫαΙΙΦρ Ϋ»γΆΦΥυ ΨΓΘœ¬Ν–ΙΊ”ΎΤ’ΖΞΥϊΆΓΒΡ–‘÷ Οη ω’ΐ»ΖΒΡ «(ΓΓΓΓ)
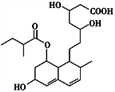
ΔΌΡή”κFeCl3»ή“ΚΖΔ…ζœ‘…ΪΖ¥”ΠΓΓΔΎΡή ΙΥα–‘KMnO4»ή“ΚΆ …ΪΓΓΔέΡήΖΔ…ζΦ”≥…ΓΔ»Γ¥ζΓΔœϊ»ΞΖ¥”ΠΓΓΔή1 molΗΟΈο÷ ΉνΕύΩ…”κ1 mol NaOHΖ¥”Π
A. ΔΌΔΎ B. ΔΎΔέ C. ΔΌΔή D. ΔΎΔή
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ≤βΕ®Β®Ζ·ΫαΨßΥ°Κ§ΝΩΒΡ≤ΌΉς÷–Θ§’ΐ»ΖΒΡ «Θ®ΓΓΓΓΘ©
A.Φ”»»ΨßΧε ±œ»”Ο–ΓΜπΘ§ΚσΫΞΗΡΈΣ”Ο¥σΜπΦ”»»÷ΝΨßΧε±δΑΉ
B.ΉΤ…’ ±»γ”–ΨßΧεΫΠ≥ω»ίΤςΘ§”Π‘ΌΦ”“Μ–©ΨßΧεΦΧ–χΦ”»»
C.Φ”»»ΚσΒΡά以Ζ≈‘ΎΗ…‘οΤς÷–Ϋχ––
D.Φ”»»ΓΔά以ΓΔ≥ΤΝΩΘ§÷ΊΗ¥Εύ¥ΈΦ¥ «Κψ÷Ί≤ΌΉς
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΫΪ2.3 gΡΤΖ≈»κ100 gΥ°÷–Θ§…ζ≥…»ή“Κ÷–»ή÷ ΒΡ÷ ΝΩΖ÷ ΐ «
A. Β»”Ύ2.3% B. Β»”Ύ4% C. ¥σ”Ύ2.3% D. ¥σ”Ύ4%
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ¬Ν–ΥΡ÷÷ά§Μχ¥ΠάμΖΫΖ®÷–Θ§ΫœΈΣΚœάμΒΡ «Θ® Θ©
A. Ε―Μΐ B. Χν¬ώ C. Ζ÷άύΜΊ ’ D. ΖΌ…’
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΙζΦ ―ß–Θ”≈―Γ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com