
【题目】某研究小组以烃A为主要原料,采用以下路线合成药物X和高聚物Y:

已知:
请回答下列问题:
(1)X的分子是为_____,X中的含氧官能团有_____________(填名称)。
(2)若反应①、反应②的原子利用率均为100%。则A的名称为_______。
(3)E的结构简式为_______,反应③的条件为______,反应⑤的反应类型是_______。
(4)写出反应④的化学方程式:_______。
(5)写出符合下列条件的E的所有同分异构体的结构简式_______。
①属于酚类化合物,且是苯的对位二元取代物; ②能发生银镜反应和水解反应。
(6)以CH3CHO为起始原料合成Z的线路(无机试剂及溶剂任选):_______。
合成路线的书写格式参照如下示例流程图:由乙醇合成乙烯的反应流程图可表示为CH3CH2OH![]() CH2=CH2
CH2=CH2![]()
![]() 。
。
【答案】 C11H12O2 酯基 乙炔 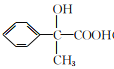 NaOH水溶液、加热 消去反应
NaOH水溶液、加热 消去反应 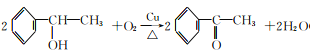
![]() 、
、![]()
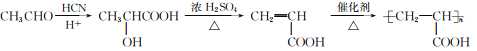
【解析】反应①、反应②的原子利用率均为100%,属于加成反应,结合反应②的产物,可知烃A为乙炔,B为苯乙烯,反应③为卤代烃在氢氧化钠水溶液加热条件下发生的水解反应,则C为![]() 。C可以发生催化氧化生成D,D发生信息Ⅰ中的反应,则D为
。C可以发生催化氧化生成D,D发生信息Ⅰ中的反应,则D为![]() ,E为
,E为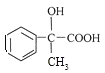 。F为
。F为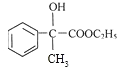 ,F分子中含有羟基,在浓硫酸加热条件下发生消去反应得到X。(1)X (
,F分子中含有羟基,在浓硫酸加热条件下发生消去反应得到X。(1)X (![]() )的分子是为C11H12O2;含氧官能团有酯基;(2)根据以上分析可知A是乙炔;(3)E的结构简式为
)的分子是为C11H12O2;含氧官能团有酯基;(2)根据以上分析可知A是乙炔;(3)E的结构简式为 ;反应③是卤代烃的水解反应,其条件是NaOH水溶液、加热;反应⑤的反应类型是消去反应;(4)根据以上分析可知反应④的化学方程式为
;反应③是卤代烃的水解反应,其条件是NaOH水溶液、加热;反应⑤的反应类型是消去反应;(4)根据以上分析可知反应④的化学方程式为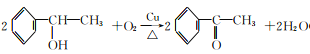 ;(5)①属于酚类化合物,且是苯的对位二元取代物。②能发生银镜反应和水解反应,含有甲酸形成的酯基,符合条件的同分异构体有
;(5)①属于酚类化合物,且是苯的对位二元取代物。②能发生银镜反应和水解反应,含有甲酸形成的酯基,符合条件的同分异构体有![]() 、
、![]() ;(6)乙醛和HCN发生加成反应,酸性条件下水解得到
;(6)乙醛和HCN发生加成反应,酸性条件下水解得到![]() ,在浓硫酸加热条件下发生消去反应生成CH2=CHCOOH,最后发生加聚反应得到
,在浓硫酸加热条件下发生消去反应生成CH2=CHCOOH,最后发生加聚反应得到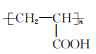 ,合成路线流程图为:
,合成路线流程图为: 。
。
点晴:本题考查机物分子式的确定,有机物的结构与性质,同分异构体的判断与测定。该类题综合性强,思维容量大,常以框图题或变相框图题的形式出现,解决这类题的关键是以反应类型为突破口,以物质类别判断为核心进行思考。经常在一系列推导关系中有部分物质已知,这些已知物往往成为思维“分散”的联结点。可以由原料结合反应条件正向推导产物,也可以从产物结合条件逆向推导原料,也可以从中间产物出发向两侧推导,审题时要抓住基础知识,结合新信息进行分析、联想、对照、迁移应用、参照反应条件推出结论。解题的关键是要熟悉烃的各种衍生物间的转化关系,不仅要注意物质官能团的衍变,还要注意同时伴随的分子中碳、氢、氧、卤素原子数目以及有机物相对分子质量的衍变。


科目:高中化学 来源: 题型:
【题目】下列几种物质:①苯;②甲苯;③乙醇;④1﹣己烯;⑤甲醛溶液;⑥乙酸;⑦苯酚溶液。既能使酸性高锰酸钾溶液褪色又能与溴水反应的是( )
A.②④⑤B.④⑤C.④⑤⑦D.③④⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒是制造光电池的一种原料,人体缺少硒就会得“克山病”,从电解精炼铜的阳极泥中提取硒的流程如下:
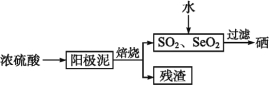
请回答下列问题:
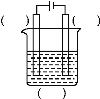
(1)实验室中电解精炼铜的简易装置如图所示,请在图中标出电极材料和电解液的名称。
(2)阳极泥中硒以Se、Ag2Se、Cu2Se等形式存在,Se与浓硫酸反应的化学方程式为 。
(3)SeO2溶于水得H2SeO3(Ka1=3.5×10-3,Ka2=5.0×10-8),亚硒酸溶液与SO2反应制硒的离子方程式为 。电解亚硒酸溶液可制得强酸H2SeO4,则电解时的阳极反应式为 。
(4)上述硒的提取过程中存在的主要问题是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法错误的是( )
A. 石油中含有C5~C11的烷烃,可以通过石油的分馏得到汽油
B. 石油的分馏是物理变化
C. 石油的分馏实验中,温度计水银球插入液面以下,因为它测的是混合液的温度
D. 石油分馏得到的汽油仍是混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,一定不能自发进行的是
A.2KClO3(s)![]() 2KCl (s)+3O2 (g) ΔH= 78. 03 kJ· mol1 ΔS=+1 110 J/(mol·K)
2KCl (s)+3O2 (g) ΔH= 78. 03 kJ· mol1 ΔS=+1 110 J/(mol·K)
B.CO(g)![]() C(石墨,s)+
C(石墨,s)+![]() O2(g) ΔH=+ 110. 5 kJ· mol1 ΔS=89.36 J/(mol·K)
O2(g) ΔH=+ 110. 5 kJ· mol1 ΔS=89.36 J/(mol·K)
C.4Fe(OH)2(s)+2H2O(l)+O2(g)![]() 4Fe(OH)3(s) ΔH=444.3 kJ·mol1 ΔS=280.1 J/(mol·K)
4Fe(OH)3(s) ΔH=444.3 kJ·mol1 ΔS=280.1 J/(mol·K)
D.NH4HCO3(s)+ CH3COOH(aq) ![]() CO2(g)+ CH3COONH4 (aq)+H2O(l) ΔH=+37.3 kJ·mol1 ΔS=+184.0 J/(mol·K)
CO2(g)+ CH3COONH4 (aq)+H2O(l) ΔH=+37.3 kJ·mol1 ΔS=+184.0 J/(mol·K)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应速率与限度与生产、生活密切相关
(1)A学生为了探究锌与盐酸反应过程中的速率变化,他在200mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL)(标准状况) | 100 | 240 | 464 | 576 | 620 |
①反应速率最大的时间段是(指0~1、1~2、2~3、3~4、4~5 )min,原因是 .
②求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率 . (设溶液体积不变)
(2)B学生也做同样的实验,但由于反应太快,测不准氢气体积,故想办法降低反应速率,请你帮他选择在盐酸中加入下列以减慢反应速率.(填写代号)
A.蒸馏水
B.冰块
C.HNO3溶液
D.CuSO4溶液
(3)某温度下在10L密闭容器中,3种气态物质A、B、C的物质的量随时间变化曲线如图. 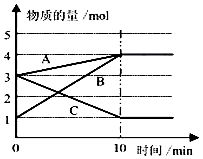
①该反应的化学方程式是 .
②求在该条件达到反应的限度(平衡状态)时反应物的转化率【转化率= ![]() ×100%】,请写出计算过程,计算结果保留1位小数)
×100%】,请写出计算过程,计算结果保留1位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,互为同系物的是( )
A.![]() 与
与![]() B.CH3(CH2)4CH3与(CH3)2CHCH(CH3)2
B.CH3(CH2)4CH3与(CH3)2CHCH(CH3)2
C.C17H35COOH与C15H31COOH D.CH3OH与HOCH2CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛酸钡粉体是电子陶瓷元器件的重要基础原料。工业以草酸盐共沉淀法获得草酸氧钛钡晶体[BaTiO(C2O4)2·4H2O],煅烧可获得钛酸钡粉体。

(1)酸浸时发生的反应的离子方程式为______________________________;为提高BaCO3的酸浸率,可采取的措施为___________________(任答一点)。
(2)配制TiCl4溶液时,通常将TiCl4溶于浓盐酸,目的是________________________。
(3)加入H2C2O4溶液时,发生反应的化学方程式为____________________________;
可循环使用的物质X是______。
(4)煅烧得到BaTiO3的同时,生成高温下的气体产物有CO、____和_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化不是由加成反应引起的是 ( )
A. 苯中加溴水振荡,溴水层褪色 B. 石油裂解后的气体通入溴水,溴水褪色
C. 乙烯在一定条件下催化聚合为聚乙烯 D. 苯转化为环已烷
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com