
【题目】常温下,将Cl2缓慢通入100mL水中至饱和,然后向所得饱和氯水中逐滴加入0.1 mol/L NaOH溶液,整个过程中溶液pH的变化如图所示。下列有关叙述正确的是
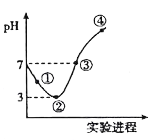
A. 溶液中c(HClO)的大小关系:①处大于②处
B. 可依据②处数据计算所溶解的n(Cl2)
C. 曲线③④段有离子反应:HClO+OH-==ClO-+H2O
D. ③处表示氯水与氢氧化钠溶液恰好反应完全
【答案】C
【解析】根据图像,pH从7-3发生:Cl2+H2O![]() HCl+HClO,②以后发生:NaOH+HCl=NaCl+H2O、HClO+NaOH=NaClO+H2O,A、根据图像,以及题意,当氯水达到饱和时,pH最小,即②时达到饱和,根据Cl2+H2O
HCl+HClO,②以后发生:NaOH+HCl=NaCl+H2O、HClO+NaOH=NaClO+H2O,A、根据图像,以及题意,当氯水达到饱和时,pH最小,即②时达到饱和,根据Cl2+H2O![]() HCl+HclO,得出②中c(HClO)大于①中,故A错误;B、氯气溶于水,有少量与水发生反应,根据信息,②无法计算溶解氯气的物质的量,故B错误;C、③处的pH=7,此时的溶质为NaCl、NaClO、HClO,因此③到④发生的反应是HClO+NaOH=NaClO+H2O,故C正确;D、根据C选项分析,完全反应溶质为NaCl和NaClO,溶液显碱性,pH不等于7,因此③处没有完全反应,故D错误。
HCl+HclO,得出②中c(HClO)大于①中,故A错误;B、氯气溶于水,有少量与水发生反应,根据信息,②无法计算溶解氯气的物质的量,故B错误;C、③处的pH=7,此时的溶质为NaCl、NaClO、HClO,因此③到④发生的反应是HClO+NaOH=NaClO+H2O,故C正确;D、根据C选项分析,完全反应溶质为NaCl和NaClO,溶液显碱性,pH不等于7,因此③处没有完全反应,故D错误。


科目:高中化学 来源: 题型:
【题目】下图表示有关物质之间的转化关系,A、C、E、G为非金属单质,其中A、G常温常压下为气态,E遇淀粉变蓝,K是一种常用食品添加剂,L是常见的无色无味液体,I为淡黄色固体,J的焰色反应呈浅紫色(透过蓝色钴玻璃)。
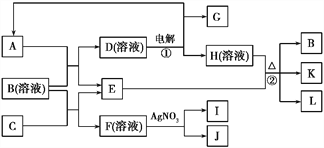
(1)B、I代表的物质化学式分别为__________、__________。
(2)写出反应①②的离子方程式:
①_________________________________________________;
②____________________________________________________________。
(3)选出实验室保存C单质的注意事项____________
A.无色瓶 B.棕色瓶 C.橡胶塞 D.玻璃塞
除此之外还采取了什么特殊保存方法:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“毒性气体”CO、NO及H2S可作为新型药物开发的潜在靶点,用以开发更多新型药物来帮助治疗多种人类疾病。下列有关这三种气体的说法正确的是( )
A.都是非电解质B.都易溶于水
C.都能与碱溶液反应D.都属于共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁晶体是一种淡黄色粉末,常用于照相显影剂及制药工业,也是电池材料的制备原料。某化学兴趣小组对草酸亚铁晶体的一些性质进行探究。
(1)甲组同学用如图所示装置测定草酸亚铁晶体(FeC2O4·xH2O)中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为ag。将样品装入石英玻璃管中,再次将装置称重,记为b g。按图连接好装置进行实验。
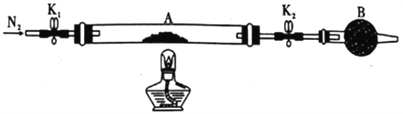
a.打开K1和K2,缓缓通入N2; b.点燃酒精灯加热; c.熄灭酒精灯;d.冷却至室温;e.关闭K1和K2; f.称重A;g.重复上述操作,直至A恒重,记为cg。
①仪器B的名称是__________ ,通入N2的目的是___________。
②根据实验记录,计算草酸亚铁晶体化学式中的x =____________(列式表示);若实验时a、b次序对调,会使x值______________ (填“偏大” “无影响”或“偏小”)。
(2)乙组同学为探究草酸亚铁的分解产物,将(1)中已恒重的装置A接入图14所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后装置A中残留固体为黑色粉末。

①装置C、G中的澄清石灰水均变浑浊,说明分解产物中有____________(填化学式)。
②装置F中盛放的物质是___________(填化学式)。
③将装置A中的残留固体溶于稀盐酸,无气泡,滴入KSCN溶液无血红色,说明分解产物中A的化学式为________。
④写出草酸亚铁(FeC2O4)分解的化学方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验设计正确的是
A. 将SO2通入溴水中证明SO2具有漂白性
B. 用向上排空气法收集铜粉与稀硝酸反应产生的NO
C. 将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中
D. 将乙烯通入KMnO4酸性溶液证明乙烯具有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以锂辉石为原料生产碳酸锂的部分工业流程如下:
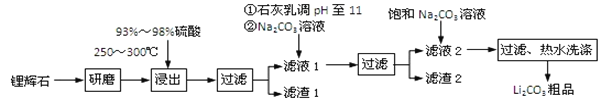
已知:
①锂辉石的主要成分为Li2O·Al2O3·4SiO2,其中含少量Ca、Mg元素。
②Li2O·Al2O3·4SiO2 + H2SO4(浓) ![]() Li2SO4 + Al2O3·4SiO2·H2O
Li2SO4 + Al2O3·4SiO2·H2O
③某些物质的溶解度(s)如下表所示。
T/℃ | 20 | 40 | 60 | 80 |
s(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
s(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
(1)从滤渣Ⅰ中分离出Al2O3的流程如下图所示。请写出生成沉淀的离子方程式______。
![]()
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3。向滤液1中加入石灰乳的作用是(运用化学平衡原理简述)________________________________________________。
(3)最后一个步骤中,用“热水洗涤”的原因是______________________________。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下:
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液做阴极液,两者用离子选择透过膜隔开,用惰性电极电解。
b.电解后向LiOH溶液中加入少量NH4HCO3溶液并共热,过滤、烘干得高纯Li2CO3。
①a中,阳极的电极反应式是_________________________
②电解后,LiOH溶液浓度增大的原因_________________,b中生成Li2CO3反应的化学方程式是___________________________________________。
(5)磷酸亚铁锂电池总反应为:FePO4+Li![]() LiFePO4,电池中的固体电解质可传导Li+,试写出该电池放电时的正极反应:__________________。
LiFePO4,电池中的固体电解质可传导Li+,试写出该电池放电时的正极反应:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由 Al、CuO、Fe2O3 组成的混合物共 10.0g,放入 500mL 某浓度盐酸溶液中,混合物完全溶解,当再 加入 250mL 2.0mol/L 的 NaOH 溶液时,得到的沉淀最多。该盐酸的浓度为( )
A. 0.5 mol/L B. 3.0 mol/L C. 1.0 mol/L D. 2.0 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度压强下,O2与CH4的混合物密度是氢气的10倍,则 O2与CH4的物质的量之比为( )
A. 1:1 B. 2:1 C. 1:2 D. 1:3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com