
【题目】工业上以锂辉石为原料生产碳酸锂的部分工业流程如下:
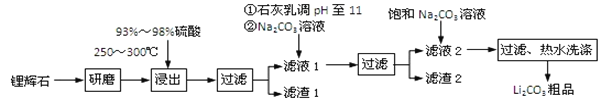
已知:
①锂辉石的主要成分为Li2O·Al2O3·4SiO2,其中含少量Ca、Mg元素。
②Li2O·Al2O3·4SiO2 + H2SO4(浓) ![]() Li2SO4 + Al2O3·4SiO2·H2O
Li2SO4 + Al2O3·4SiO2·H2O
③某些物质的溶解度(s)如下表所示。
T/℃ | 20 | 40 | 60 | 80 |
s(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
s(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
(1)从滤渣Ⅰ中分离出Al2O3的流程如下图所示。请写出生成沉淀的离子方程式______。
![]()
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3。向滤液1中加入石灰乳的作用是(运用化学平衡原理简述)________________________________________________。
(3)最后一个步骤中,用“热水洗涤”的原因是______________________________。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下:
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液做阴极液,两者用离子选择透过膜隔开,用惰性电极电解。
b.电解后向LiOH溶液中加入少量NH4HCO3溶液并共热,过滤、烘干得高纯Li2CO3。
①a中,阳极的电极反应式是_________________________
②电解后,LiOH溶液浓度增大的原因_________________,b中生成Li2CO3反应的化学方程式是___________________________________________。
(5)磷酸亚铁锂电池总反应为:FePO4+Li![]() LiFePO4,电池中的固体电解质可传导Li+,试写出该电池放电时的正极反应:__________________。
LiFePO4,电池中的固体电解质可传导Li+,试写出该电池放电时的正极反应:__________________。
【答案】 Al3+ + 3NH3·H2O == Al(OH)3 ↓+ 3NH4+ Ca(OH)2![]() Ca2++2OH-,Mg2+与OH-结合生成Ksp很小的Mg(OH)2沉淀,导致平衡右移,生成Mg(OH)2沉淀 Li2CO3的溶解度随温度升高而减小 2Cl-—2e-==Cl2 阴极氢离子放电,锂离子向阴极移动 2LiOH+NH4HCO3
Ca2++2OH-,Mg2+与OH-结合生成Ksp很小的Mg(OH)2沉淀,导致平衡右移,生成Mg(OH)2沉淀 Li2CO3的溶解度随温度升高而减小 2Cl-—2e-==Cl2 阴极氢离子放电,锂离子向阴极移动 2LiOH+NH4HCO3![]() Li2CO3 +2H2O+NH3 ↑ FePO4+Li++ e- = LiFePO4
Li2CO3 +2H2O+NH3 ↑ FePO4+Li++ e- = LiFePO4
【解析】本题考查化学化学工艺流程,(1)根据流程,生成沉淀,需要加入过量试剂a,因为Al(OH)3溶于强碱,不溶于弱碱,因此试剂a为NH3·H2O,发生的离子反应方程式为Al3++3NH3·H2O=Al(OH)3↓+3NH4+;(2)石灰乳中存在Ca(OH)2 ![]() Ca2++2OH-,Ca(OH)2属于微溶物,Mg(OH)2属于难溶物,Mg2+结合Ca(OH)2电离产生的OH-生成更难溶的Mg(OH)2,使平衡向右移动,生成氢氧化镁沉淀;(3)根据流程图,制备Li2CO3,根据信息③中溶解度,Li2CO3溶解度随着温度的升高而降低,因此热水洗涤的目的是减少Li2CO3的损失;(4)①根据电解原理,阳极上应是阴离子放电,因此电极反应式为2Cl--2e-=Cl2↑;②根据电解原理,阴极反应式为2H2O+2e-=H2↑+2OH-,阳离子向阴极移动,因此LiOH浓度增大;根据b提供信息,HCO3-与OH-反应生成CO32-和H2O,碳酸锂溶解度较小,因此生成碳酸锂的化学反应方程式为:2LiOH+NH4HCO3
Ca2++2OH-,Ca(OH)2属于微溶物,Mg(OH)2属于难溶物,Mg2+结合Ca(OH)2电离产生的OH-生成更难溶的Mg(OH)2,使平衡向右移动,生成氢氧化镁沉淀;(3)根据流程图,制备Li2CO3,根据信息③中溶解度,Li2CO3溶解度随着温度的升高而降低,因此热水洗涤的目的是减少Li2CO3的损失;(4)①根据电解原理,阳极上应是阴离子放电,因此电极反应式为2Cl--2e-=Cl2↑;②根据电解原理,阴极反应式为2H2O+2e-=H2↑+2OH-,阳离子向阴极移动,因此LiOH浓度增大;根据b提供信息,HCO3-与OH-反应生成CO32-和H2O,碳酸锂溶解度较小,因此生成碳酸锂的化学反应方程式为:2LiOH+NH4HCO3![]() Li2CO3 +2H2O+NH3 ↑;(5)根据原电池的工作原理,正极上发生还原反应,得到电子,因此FePO4在正极上发生反应,即正极反应式为FePO4+Li++e-=LiFePO4。
Li2CO3 +2H2O+NH3 ↑;(5)根据原电池的工作原理,正极上发生还原反应,得到电子,因此FePO4在正极上发生反应,即正极反应式为FePO4+Li++e-=LiFePO4。


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】人工肾脏可采用间接电化学方法除去代谢产物中的尿素,原理如下图所示。
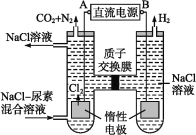
(1)电源的负极为 (填“A”或“B”)。
(2)阳极室中发生的反应依次为 、 。
(3)电解结束后,阴极室溶液的pH与电解前相比将 ;若两极共收集到气体13.44 L(标准状况),则除去的尿素为 g(忽略气体的溶解)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物;C单质一般保存在煤油中;F的最高价氧化物对应的水化物既能与强酸反应又能与强碱反应,G单质是日常生活中用量最大的金属,易被腐蚀或损坏。请回答下列问题:
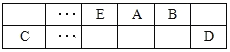
(1)A元素的氢化物水溶液能使酚酞变红的原因用电离方程式解释为_____________。
(2)同温同压下,将a L A氢化物的气体和b L D的氢化物气体先后通入一盛水的烧杯中,若所得溶液的pH=7,则a_________b(填“>"或“<”或“=”)。
(3)常温下,相同浓度F、G简单离子的溶液中滴加NaOH溶液,F、G两元素先后沉淀,F(OH)n完全沉淀的pH是4.7,G(OH)n完全沉淀的pH是2.8,则在相同条件下,溶解度较大的是:___(填化学式)。
(4)A与B可组成质量比为7:16的三原子分子,该分子释放在空气中其化学作用可能引发的后果有:_______________。
①酸雨 ②温室效应 ③光化学烟雾 ④臭氧层破坏
(5)A和C组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是______。
(6)用电子式表示B,C形成化合物C2B2的过程_______________。
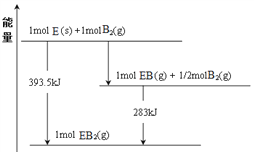
(7)已知一定量的E单质能在B2(g)中燃烧,其可能的产物及能量关系如下图所示:请写出一定条件下EB2(g) 与E(s)反应生成EB(g)的热化学方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某仅由碳、氢、氧三种元素组成的有机化合物,经测定其相对分子质量为90。取有机物样品1.8 g,在纯氧中完全燃烧,将产物先后通过浓硫酸和碱石灰,两者分别增重1.08 g和2.64 g。试求该有机物的分子式。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将Cl2缓慢通入100mL水中至饱和,然后向所得饱和氯水中逐滴加入0.1 mol/L NaOH溶液,整个过程中溶液pH的变化如图所示。下列有关叙述正确的是
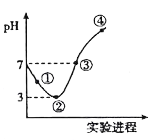
A. 溶液中c(HClO)的大小关系:①处大于②处
B. 可依据②处数据计算所溶解的n(Cl2)
C. 曲线③④段有离子反应:HClO+OH-==ClO-+H2O
D. ③处表示氯水与氢氧化钠溶液恰好反应完全
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物 ①CH2OH(CHOH)4CHO、②CH3CH2CH2OH、③CH2=CH—CH2OH、④CH2=CH—COOCH3、⑤CH2=CH—COOH中,既能发生加成反应和酯化反应,又能发生氧化反应的是 ( )
A.③⑤B.①③⑤C.②④D.①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实与胶体性质无关的是( )
A. 在豆浆里加入盐卤做豆腐
B. 三氯化铁溶液中滴入氢氧化钠溶液出现红褐色沉淀
C. 在河流入海口易形成沙洲
D. 一束平行光线照射蛋白质溶液时,从侧面可以看到一条光亮的通路
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列金属元素的单质或化合物在火焰上灼烧时,通过蓝色钴玻璃观察到焰色为紫色的是( )
A. KNO3 B. NaCl C. MgCl2 D. Cu
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com