
【题目】人工肾脏可采用间接电化学方法除去代谢产物中的尿素,原理如下图所示。
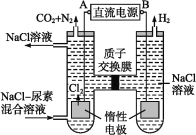
(1)电源的负极为 (填“A”或“B”)。
(2)阳极室中发生的反应依次为 、 。
(3)电解结束后,阴极室溶液的pH与电解前相比将 ;若两极共收集到气体13.44 L(标准状况),则除去的尿素为 g(忽略气体的溶解)。
【答案】(1)B (2)6Cl--6e-3Cl2↑ CO(NH2)2+3Cl2+H2ON2+CO2+6HCl (3)不变 7.2
【解析】
试题分析:根据电解池中阴离子在阳极放电和阳离子在阴极放电的规律和本题图中的电极产物H2和Cl2可以判断出A为电源的正极,B为电源的负极,故阳极室中发生的反应依次为:2Cl--2e-Cl2↑,CO(NH2)2+3Cl2+H2ON2+CO2+6HCl;
(3)阴极反应为:6H2O+6e-6OH-+3H2↑(或6H++6e-3H2↑)
阳极反应为:6Cl--6e-3Cl2↑
CO(NH2)2+3Cl2+H2ON2+CO2+6HCl
根据上述反应可以看出在阴、阳极上产生的OH-、H+的数目相等,阳极室中反应产生的H+通过质子交换膜进入阴极室与OH-恰好反应生成水,所以阴极室中电解前后溶液的pH不变;由上述反应可以看出,转移6 mol e-时,阴极产生3 mol H2,阳极产生1 mol N2和1 mol CO2,故电解收集到的13.44 L气体中V(N2)=V(CO2)==2.688 L,即n(N2)=n(CO2)=0.12 mol。
根据方程式CO(NH2)2+3Cl2+H2ON2+CO2+6HCl可知生成0.12 mol N2所消耗的CO(NH2)2的物质的量也为0.12 mol,其质量为:m[CO(NH2)2]=0.12 mol×60 g·mol-1=7.2 g。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列变化需加入还原剂的是 ( )
A. HCO3-→CO2 B. MnO4-→Mn2+ C. FeO→Fe3O4 D. H3AlO3→HAlO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子在无色溶液中能大量共存的是( )
A. Fe3+、NH4+、OH-、Cl- B. Na+、H+、NO3-、SO42-
C. Fe2+、Fe3+、Na+、NO3- D. Fe2+、NH4+、Cl-、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示有关物质之间的转化关系,A、C、E、G为非金属单质,其中A、G常温常压下为气态,E遇淀粉变蓝,K是一种常用食品添加剂,L是常见的无色无味液体,I为淡黄色固体,J的焰色反应呈浅紫色(透过蓝色钴玻璃)。
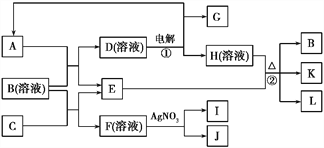
(1)B、I代表的物质化学式分别为__________、__________。
(2)写出反应①②的离子方程式:
①_________________________________________________;
②____________________________________________________________。
(3)选出实验室保存C单质的注意事项____________
A.无色瓶 B.棕色瓶 C.橡胶塞 D.玻璃塞
除此之外还采取了什么特殊保存方法:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知M2O7x- + 3 S2- + 14 H+ = 2 M 3+ + 3S ↓ + 7H2O,则M2O7x-中的M的化合价为( )
A. +2 B. +3 C. +4 D. +6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的钠、镁、铝分别与足量盐酸反应,产生H2的质量由大到小排列顺序正确的
A.Al、Mg、Na B.Mg、Al、Na C.Na、Mg、Al D.Na、Al、Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-QkJ/mol (Q>0) 在850℃时,K=1。
CO2(g)+H2(g) △H=-QkJ/mol (Q>0) 在850℃时,K=1。
①写出该反应的化学平衡常数的表达式K=__________。
②若升高温度到950℃,达到平衡时K____1 (填“大于”“ 小于”或“等于”),理由是__________。
③ 850℃时,若向一容积可变的密闭容器中同时充入1.0molCO,3.0molH2O,1.0molCO2和xmolH2,则:当x=5.0时,上述反应向_______________方向进行(填“正反应”或“逆反应”)。
④上述反应达平衡后,扩大该容器体积,平衡___________(正向移动、逆向移动或不移动)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以锂辉石为原料生产碳酸锂的部分工业流程如下:
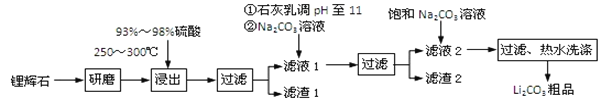
已知:
①锂辉石的主要成分为Li2O·Al2O3·4SiO2,其中含少量Ca、Mg元素。
②Li2O·Al2O3·4SiO2 + H2SO4(浓) ![]() Li2SO4 + Al2O3·4SiO2·H2O
Li2SO4 + Al2O3·4SiO2·H2O
③某些物质的溶解度(s)如下表所示。
T/℃ | 20 | 40 | 60 | 80 |
s(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
s(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
(1)从滤渣Ⅰ中分离出Al2O3的流程如下图所示。请写出生成沉淀的离子方程式______。
![]()
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3。向滤液1中加入石灰乳的作用是(运用化学平衡原理简述)________________________________________________。
(3)最后一个步骤中,用“热水洗涤”的原因是______________________________。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下:
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液做阴极液,两者用离子选择透过膜隔开,用惰性电极电解。
b.电解后向LiOH溶液中加入少量NH4HCO3溶液并共热,过滤、烘干得高纯Li2CO3。
①a中,阳极的电极反应式是_________________________
②电解后,LiOH溶液浓度增大的原因_________________,b中生成Li2CO3反应的化学方程式是___________________________________________。
(5)磷酸亚铁锂电池总反应为:FePO4+Li![]() LiFePO4,电池中的固体电解质可传导Li+,试写出该电池放电时的正极反应:__________________。
LiFePO4,电池中的固体电解质可传导Li+,试写出该电池放电时的正极反应:__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com